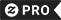Toque/clique na imagem para ver mais RealViewsTM
R$ 43,70
por cada chaveiro
Chaveiro Falo de nomenclatura de química IUPAC
Quantidade:
Modelo
Círculo de Alumínio
+R$ 3,85
+R$ 3,85
+R$ 95,30
+R$ 95,30
Sobre Porta chaves
Feito por
Sobre Esse Design
Chaveiro Falo de nomenclatura de química IUPAC
Química (do árabe: ك ي ي ا ء latinizada: chem (kēme), que significa "valor") é a ciência da matéria e as mudanças que ela sofre. A ciência da matéria também é abordada pela física, mas enquanto a física adota uma abordagem mais geral e fundamental, a química é mais especializada, preocupada com a composição, o comportamento, a estrutura e as propriedades da matéria, além das mudanças que ela sofre durante as reações químicas. É uma ciência física para estudos de vários átomos, moléculas, cristais e outros agregados de matéria, isoladamente ou em combinação, que incorpora os conceitos de energia e entropia em relação à espontaneidade de processos químicos. As disciplinas dentro da química são tradicionalmente agrupadas pelo tipo de matéria estudada ou pelo tipo de estudo. Entre eles estão a química inorgânica, o estudo da matéria inorgânica, a química orgânica, o estudo da matéria orgânica, a bioquímica, o estudo de substâncias encontradas em organismos biológicos, a química física, os estudos de sistemas químicos relacionados à energia em escalas macro, molecular e submolecular, a química analítica, a análise de amostras de material para entender sua composição e estrutura químicas. Nos últimos anos, surgiram muitas outras disciplinas especializadas, por exemplo, a neuroquímica e o estudo químico do sistema nervoso (ver subdisciplinas). Resumo Química é o estudo científico da interação de substâncias químicas que são constituídas por átomos ou partículas subatômicas: prótons, elétrons e nêutrons. Átomos se combinam para produzir moléculas ou cristais. A química é muitas vezes chamada de "ciência central" porque liga as outras ciências naturais como astronomia, física, ciência de materiais, biologia e geologia. A gênese da química pode ser traçada a certas práticas, conhecidas como alquimia, que haviam sido praticadas por vários milênios em várias partes do mundo, principalmente no Oriente Médio. A estrutura dos objetos que usamos comumente e as propriedades da matéria com a qual interagimos comumente são uma consequência das propriedades das substâncias químicas e suas interações. Por exemplo, o aço é mais duro que o ferro porque seus átomos estão ligados em uma camada cristalina mais rígida; a madeira queima ou sofre oxidação rápida porque pode reagir espontaneamente com oxigênio em uma reação química acima de uma certa temperatura; o açúcar e o sal se dissolvem na água porque suas propriedades moleculares/iônicas são tais que a dissolução é preferida nas condições ambientes. As transformações que são estudadas na química são resultado da interação entre diferentes substâncias químicas ou entre matéria e energia. A química tradicional envolve o estudo de interações entre substâncias em um laboratório de química usando várias formas de vidro de laboratório. Laboratório, Instituto de Bioquímica de Colônia Uma reação química é uma transformação de algumas substâncias em uma ou mais outras substâncias. Pode ser representado simbolicamente através de uma equação química. O número de átomos à esquerda e à direita na equação para uma transformação química é muitas vezes igual. A natureza das reações químicas a que uma substância pode sofrer e as mudanças de energia que a podem acompanhar são condicionadas por certas regras básicas, conhecidas como leis químicas. As considerações sobre energia e entropia são invariavelmente importantes em quase todos os estudos químicos. As substâncias químicas são classificadas em termos de estrutura, fase e composição química. Podem ser analisados utilizando as ferramentas de análise química, por exemplo, espectroscopia e cromatografia. A química é parte integrante do currículo científico, tanto no segundo grau como no nível inicial. Nesses níveis, é muitas vezes chamada de "química geral", que é uma introdução a uma grande variedade de conceitos fundamentais que permitem ao aluno adquirir ferramentas e habilidades úteis nos níveis avançados, em que a química é invariavelmente estudada em qualquer uma de suas várias subdisciplinas. Cientistas envolvidos na pesquisa química são conhecidos como químicos. A maioria dos químicos é especializada em uma ou mais subdisciplinas. História Antigos Egípcios foram pioneiros na arte da química sintética "molhada" até 4.000 anos atrás. Em 1000 a.C., civilizações antigas usavam tecnologias que formavam a base de vários ramos da química, como extrair metal de seus minérios, cerâmica e esmaltes de fazeres, fermentando cerveja e vinho, pigmentos de fazer para cosméticos e pintura, extrair produtos químicos de plantas para medicina e perfume, queijo de fazer, roupas de curtimenta, tornar gordura em sabão, vidro de fazer e fazer ligas como bronze. A gênese da química pode ser traçada ao fenômeno amplamente observado da queima que levou à metalurgia — a arte e a ciência dos minérios de processamento para obter metais (por exemplo, a metalurgia na Índia antiga). A ganância do ouro levou à descoberta do processo de purificação, ainda que os princípios subjacentes não fossem bem compreendidos — pensava-se que era uma preferencialmente de transformação que de purificação. Naquela época, muitos estudiosos achavam razoável acreditar que havia meios para transformar metais mais baratos (base) em ouro. Isso deu lugar à alquimia e à busca da Pedra do Filósofo que se acreditava trazer tal transformação por mero atomismo táctil remonta a 440 a.C., como indica o livro De Rerum Natura (A Natureza das Coisas) escrito pelo romano Lucretiusin 50 a.C. Grande parte do desenvolvimento precoce de métodos de purificação é descrita por Pliny, o Velho, na sua Historia Naturalis. Um esboço provisório é o seguinte: 1. Alquimia egípcia [3.000 AEC - 400 AEC], formula teorias "elementos" iniciais como a Ogdoad. 2 alquimia [332 BCE - 642 CE], o rei Alexandre, o Excelente, conquistou o Egito e encontrou Alexandria, tendo a maior biblioteca do mundo, onde acadêmicos e sábios se reúnem para estudar. 3. Alquimia árabe [642 CE - 1200], a conquista muçulmana do Egito (principalmente Alexandria); desenvolvimento do Método Científico por Alhazen e Jābir ibn Hayyān revoluciona o campo da Química. 4. A Casa da Sabedoria (Árabe: ب ي ل ح ا ك م ت ة ا ل أ ن د ل س ا ل إ; Bait al-Hikma), Al-Andalus (Árabe: س ك ن د ر ي ة a) e Alexandria (Arábica: e. 5. Jābir ibn Hayyān, al-Kindi, al-Razi, al-Biruni e Alhazen continuam dominando o campo da Química, dominando-o e ampliando os limites do conhecimento e da experimentação. 6. Alquimia europeia [1300 - presente], o Pseudo-Geber baseia-se na química árabe. 7. Química [1661], Boyle escreve seu texto clássico de química The Skeptical Chymist. 8. Química [1787], Lavoisier escreve seus clássicos Elementos Químicos. 9. Química [1803], Dalton publica sua Teoria Atômica. Os primeiros pioneiros da Química, e inventores do método científico moderno, foram estudiosos árabes e persa medievais. Introduziram uma observação precisa e uma experimentação controlada no terreno e descobriram numerosas substâncias químicas[14]. "A química como ciência foi quase criada pelos muçulmanos; pois, neste domínio, onde os gregos (tanto quanto sabemos) se limitaram à experiência industrial e à vaga hipótese, os Saracens introduziram uma observação precisa, uma experiência controlada e registros cuidadosos. Inventaram e batizaram a alembia (al-anbiq), analisaram quimicamente inúmeras substâncias, lapidárias compostas, distintos alcalinos e ácidos, investigaram suas afinidades, estudaram e fabricaram centenas de medicamentos. A alquimia, que os muçulmanos herdaram do Egito, contribuiu para a química por mil descobertas incidentais, e pelo seu método, que foi o mais científico de todas as operações medievais." Os químicos muçulmanos mais influentes foram Jābir ibn Hayyān (d. 815), al-Kindi (d. 873), al-Razi (d. 925), al-Biruni (d. 1048) e Alhazen (d. 1039). As obras de Jābir tornaram-se mais conhecidas na Europa através de traduções latinas feitas por um pseudo-Geber na Espanha do século 14, que também escreveu alguns de seus próprios livros sob o nome de caneta "Geber". A contribuição dos alquimistas e metalurgistas indianos no desenvolvimento da química também foi bastante significativa. O aparecimento da química na Europa deveu-se principalmente à incidência recorrente da praga e aos seus flagelos durante a chamada Idade das Trevas. Isto deu origem à necessidade de medicamentos. Pensava-se que existe um medicamento universal chamado Elixir da Vida que pode curar todas as doenças, mas como a Pedra Filosofal, ela nunca foi encontrada. Para alguns praticantes, alquimia era uma busca intelectual, com o tempo, eles melhoraram. Paracelso (1493-1541), por exemplo, rejeitou a teoria dos 4 elementos e, com pouco conhecimento de seus químicos e medicamentos, formou um híbrido de alquimia e ciência no que se chamaria de bioquímica. Da mesma forma, as influências de filósofos como Francis Bacon (1561-1626) e René Descartes (1596-1650), que exigiram mais rigor na matemática e na retirada do viés das observações científicas, levaram a uma revolução científica. Na química, isso começou com Robert Boyle (1627-1691), que criou uma equação conhecida como Lei de Boyle sobre as características do estado gasoso. A química, aliás, envelheceu quando Antoine Lavoisier (1743-1794), desenvolveu a teoria da Conservação da Massa em 1783 e o desenvolvimento da Teoria Atômica por John Dalton em torno de 1800. A Lei de Conservação da Massa resultou na reformulação da química baseada nessa lei e na teoria da combustão do oxigênio, que se baseava em grande parte no trabalho de Lavoisier. As contribuições fundamentais de Lavoisier para a química foram resultado de um esforço consciente de ajustado de todos os experimentos no quadro da teoria do solteiro. Estabeleceu o uso consistente do balanço químico, usou oxigênio para derrubar a teoria do phlogiston, desenvolveu um novo sistema de nomenclatura química e contribuiu para o sistema métrico moderno. Lavoisier também trabalhou para traduzir a linguagem arcaica e técnica da química em algo que pudesse ser facilmente compreendido pelas massas amplamente não-educadas, levando a um maior interesse público pela química. Todos esses avanços na química levaram ao que normalmente se chama de revolução química. As contribuições de Lavoisier levaram à chamada química moderna — química estudada em instituições educacionais de todo o mundo. É devido a estas e outras contribuições que Antoine Lavoisier é frequentemente celebrado como o "Pai da Química Moderna"[18]. A descoberta posterior de Friedrich Wöhler de que muitas substâncias naturais, compostos orgânicos, podem ser sintetizadas num laboratório de química também ajudou a química moderna a amadurecer desde a infância. A descoberta dos elementos químicos tem uma longa história dos tempos da alquimia e culmina na descoberta da mesa periódica dos elementos químicos por Dmitri Mendeleev (1834-1907) e, posteriormente, descobertas de alguns elementos sintéticos. Etimologia Artigo principal: Química (etimologia) A palavra química vem do estudo anterior da alquimia, que é um conjunto de práticas que engloba elementos da química, metalurgia, filosofia, astrologia, astronomia, misticismo e medicina. Por sua vez, a alquimia deriva da palavra árabe "ك ي ي ا ء", que significa "valor", é geralmente considerada como a tentativa de transformar chumbo ou outro material inicial comum em ouro[21]. Pensa-se que essa relação linguística entre a busca do valor e a alquimia tenha origens egípcias. Muitos acreditam que a palavra árabe "alquimia" deriva da palavra Chemi ou Kimi, que é o antigo nome do Egito no Egito[22][23][24]. A palavra foi posteriormente emprestada pelos gregos, e pelos gregos pelos árabes quando ocuparam Alexandria (Egito) no século 7. Os árabes adicionaram o artigo definido árabe "al" à palavra, resultando na palavra (al-kīmiyā). Assim, um alquimista era chamado de 'químico' na fala popular, e mais tarde o sufixo "-ry" foi adicionado a isso para descrever a arte do químico como "química". Definições Em retrospectiva, a definição de química parece mudar invariavelmente por década, à medida que novas descobertas e teorias aumentam a funcionalidade da ciência. Apresentam-se a seguir algumas das definições-padrão utilizadas por vários químicos notáveis: ・ Alquimia (330) - estudo da composição das águas, movimento, crescimento, incorporação, desmontagem, desenho das bebidas espirituosas dos corpos e ligação das aguardentes aos corpos (Zosimos). ・ Química (1661) - tema dos princípios materiais das misturas (Boyle). ・ Química (1663) - uma arte científica pela qual se aprende a dissolver corpos e a desenhar deles das diferentes substâncias em sua composição, e como reuni-los novamente, e exaltá-los a uma perfeição de mais alto (Glaser). ・ Química (1730) - a arte de resolver os corpos misturados, compostos ou agregados nos seus princípios; e de compor esses corpos a partir desses princípios (Stahl). ・ Química (1837) - a ciência relacionada com as leis e efeitos das forças moleculares (Dumas). ・ Química (1947) - ciência das substâncias: sua estrutura, suas propriedades e as reações que as transformam em outras substâncias (Pauling). ・ Química (1998) - o estudo da matéria e as mudanças que ela sofre (Chang). Conceitos básicos Vários conceitos são essenciais para o estudo da química, alguns deles são: Atom Main, artigo: Atom An atom é a unidade básica da química. Consiste de um núcleo de carga positiva (núcleo atômico) que contém prótons e nêutrons e mantém uma série de elétrons para equilibrar a carga positiva no núcleo. O átomo é também a entidade mais pequena que pode ser considerada para reter algumas das propriedades químicas do elemento, como a eletrônica, o potencial de ionização, o(s) estado(s) de oxidação preferido(s), o número de coordenação e tipos preferidos de ligações (por exemplo, metal, iônico, covalente). Elemento Principal: Elemento químico O conceito de elemento químico está relacionado com o conceito de substância química. Um elemento químico é caracterizado por um número específico de prótons nos núcleos de seus átomos. Esse número é conhecido como o número atômico do elemento. Por exemplo, todos os átomos com 6 prótons em seus núcleos são átomos do elemento químico carbono e todos os átomos com 92 prótons em seus núcleos são átomos do elemento urânio. Existem naturalmente 94 diferentes elementos químicos ou tipos de átomos baseados no número de prótons. Outros 18 foram reconhecidos pela IUPAC como existindo apenas artificialmente. Embora todos os núcleos de todos os átomos pertencentes a um elemento tenham o mesmo número de prótons, talvez não tenham necessariamente o mesmo número de nêutrons, tais átomos são chamados de isótopos. Na verdade, podem existir vários isótopos de um elemento. A apresentação mais conveniente dos elementos químicos está na mesa periódica dos elementos químicos, que agrupa elementos por número atômico. Devido à sua engenhosa disposição, grupos, ou colunas, e períodos, ou linhas, de elementos da mesa compartilham várias propriedades químicas ou seguem uma certa tendência em características como o raio atômico, a eletrônica, etc. Também estão disponíveis listas dos elementos por nome, por símbolo e por número atômico. Artigo principal composto: Composto químico Composto Um composto é uma substância com uma relação específica de átomos de determinados elementos químicos que determina a sua composição e uma organização específica que determina as propriedades químicas. Por exemplo, a água é um composto que contém hidrogênio e oxigênio na proporção de dois para um, com o átomo de oxigênio entre os dois átomos de hidrogênio, e um ângulo de 104,5° entre eles. Os compostos são formados e interconvertidos por reações químicas. Substância Artigo principal: Substância química Uma substância química é um tipo de matéria com composição e conjunto de propriedades definidos[33]. A rigor, uma mistura de compostos, elementos ou compostos e elementos não é uma substância química, mas pode ser chamada de química. A maioria das substâncias que encontramos no nosso dia a dia são um tipo de mistura, por exemplo: ar, ligas, biomassa, etc. A nomenclatura das substâncias é uma parte crítica da linguagem química. Em geral, refere-se a um sistema de nomeação de compostos químicos. No início da história das substâncias químicas, o seu descobridor deu o nome, o que muitas vezes levou a alguma confusão e dificuldade. No entanto, hoje, o sistema de nomenclatura química da IUPAC permite que os químicos especifiquem por nome compostos específicos entre a vasta variedade de possíveis produtos químicos. A nomenclatura normalizada das substâncias químicas é estabelecida pela União Internacional de Química Pura e Aplicada (IUPAC). Existem sistemas bem definidos para nomear espécies químicas. Os compostos orgânicos são designados de acordo com o sistema de nomenclatura biológica[34]. Os compostos inorgânicos são designados de acordo com o sistema de nomenclatura inorgânica[35]. Além disso, o Serviço de Abstratos Químicos elaborou um método de indexação das substâncias químicas. Neste regime, cada substância química é identificável por um número conhecido como número de registro CAS. Molécula Principal: Molécula A é a menor porção indivisível, além de um átomo, de uma substância química pura que tem seu conjunto único de propriedades químicas, ou seja, seu potencial para sofrer um certo conjunto de reações químicas com outras substâncias. As moléculas podem existir como unidades eletricamente neutras, ao contrário dos iões. As moléculas são tipicamente um conjunto de átomos unidos por ligações covalentes, de modo que a estrutura é eletricamente neutra e todos os elétrons de valência são emparelhados com outros elétrons em ligações ou em pares solitários. Uma estrutura molecular retrata as ligações e posições relativas dos átomos numa molécula como a do Paclitaxel aqui mostrada Uma das principais características de uma molécula é sua geometria muitas vezes chamada de sua estrutura. Enquanto a estrutura das moléculas diatômicas, triatômicas ou tetra atômicas pode ser trivial, (linear, piramidal angular etc.) a estrutura das moléculas polimatômicas, constituídas por mais de seis átomos (de vários elementos), pode ser crucial para sua natureza química. Artigo principal: Mole (unidade) Um mole é a quantidade de uma substância que contém tantas entidades elementares (átomos, moléculas ou íons) como existem átomos em 0,012 kg (ou 12 gramas) de carbono-12, onde os átomos de carbono-12 estão desligados, em repouso e no seu estado de terra[36]. Este número é conhecido como a constante de Avogadro e é determinado empiricamente. O valor atualmente aceite é 6,02214179(30) × 1023 mol-1 (CODATA 2007). A melhor maneira de entender o significado do termo "toupeira" é compará-lo a termos como dúzia. Assim como uma dúzia é igual a 12, uma mole é igual a 6,02214179(30) × 1023. O termo é usado porque é muito mais fácil dizer, por exemplo, 1 mole de átomos de carbono, do que dizer 6,02214179(30) × 1023 átomos de carbono. Da mesma forma, podemos descrever o número de entidades como um múltiplo ou fração de 1 mole, por exemplo, 2 mole ou 0,5 moles. Mole é um número absoluto (sem unidades) e pode descrever qualquer tipo de objeto elementar, embora o uso da molécula seja normalmente limitado à medição de estruturas subatômicas, atômicas e moleculares. O número de moles de uma substância em um litro de solução é conhecido como sua molaridade. Molaridade é a unidade comum usada para expressar a concentração de uma solução em química física. Íons e sais Artigo principal: Íon Um íon é uma espécie carregada, um átomo ou uma molécula, que perdeu ou ganhou um ou mais elétrons. Os catiões de carga positiva (por exemplo, catião de sódio Na+) e os aniões de carga negativa (por exemplo, cloreto Cl-) podem formar uma camada cristalina de sais neutros (por exemplo, cloreto de sódio NaCl). Exemplos de iões poliatômicos que não se dividem durante reações à base de ácidos são hidróxido (OH-) e fosfato (PO43-). Os íons na fase gasosa são muitas vezes conhecidos como plasma. Acidez e basicidade Artigo principal: Ácido Uma substância pode frequentemente ser classificada como ácido ou base. Isto é frequentemente feito com base num tipo particular de reação, nomeadamente a troca de prótons entre compostos químicos. Mas uma extensão desse modo de classificação foi feita pelo químico norte-americano Gilbert Newton Lewis, que nesse modo de classificação a reação não se limita às que ocorrem em solução aquosa, não se restringindo mais às soluções em água. De acordo com o conceito de Lewis, as coisas cruciais que estão sendo trocadas são cargas Existem várias outras formas pelas quais uma substância pode ser classificada como ácido ou base, como é evidente na história deste conceito Fase principal: Fase (matéria) Além das propriedades químicas específicas que distinguem diferentes classificações químicas, podem existir em várias fases. Na sua maioria, as classificações químicas são independentes destas classificações de fase a granel, mas algumas fases mais exóticas são incompatíveis com determinadas propriedades químicas. Uma fase é um conjunto de estados de um sistema químico que tem propriedades estruturais a granel semelhantes, numa série de condições, como pressão ou temperatura. As propriedades físicas, como densidade e índice de refração, tendem a se enquadrar em valores característicos da fase. A fase da matéria é definida pela transição de fase, que é quando a energia introduzida ou retirada do sistema entra em rearranjo da estrutura do sistema, em vez de mudar as condições gerais. Por vezes, a distinção entre fases pode ser contínua em vez de ter uma fronteira discreta, neste caso a questão é considerada como estando num estado supercrítico. Quando três estados se encontram com base nas condições, é conhecido como um ponto triplo e, como isso é invariável, é uma forma conveniente de definir um conjunto de condições. Os exemplos mais familiares de fases são sólidos, líquidos e gases. Muitas substâncias apresentam múltiplas fases sólidas. Por exemplo, há três fases de ferro sólido (alfa, gama e delta) que variam com base na temperatura e na pressão. Uma diferença principal entre fases sólidas é a estrutura cristalina, ou arranjo, dos átomos. Outra fase comumente encontrada no estudo da química é a fase aquosa, que é o estado das substâncias dissolvidas em solução aquosa (ou seja, em água). As fases menos familiares incluem os plasmas, os condensados de Bose-Einstein e os condensados fermônicos e as fases paramagnéticas e ferromagnéticas dos materiais magnéticos. Embora a maioria das fases conhecidas trate de sistemas tridimensionais, é possível também definir analogias em sistemas bidimensionais, que receberam atenção por sua relevância para sistemas em biologia. Redox Principal artigo: Redox É um conceito relacionado à capacidade de átomos de várias substâncias para perder ou ganho de elétrons. As substâncias que têm a capacidade de oxidar outras substâncias são consideradas oxidativas e conhecidas como agentes oxidantes, oxidantes ou oxidantes. Um oxidante retira elétrons de outra substância. Do mesmo modo, as substâncias que têm capacidade para reduzir outras substâncias são consideradas redutoras e conhecidas como redutores, redutores ou redutores. Um redutor transfere elétrons para outra substância, sendo assim oxidado por si mesmo. E porque "doa" elétrons, ele também é chamado de doador de elétrons. A oxidação e a redução referem-se corretamente a uma mudança no número de oxidação — a transferência real de elétrons pode nunca ocorrer. Assim, a oxidação é melhor definida como aumento do número de oxidação e redução como diminuição do número de oxidação. Ligação de eletrões atômicos e órbitas moleculares Os átomos que se unem em moléculas ou cristais são considerados ligados entre si. Uma ligação química pode ser visualizada como o equilíbrio multipolar entre as cargas positivas nos núcleos e as cargas negativas oscilando sobre eles. Mais do que simples atração e repulsão, as energias e distribuições caracterizam a disponibilidade de um elétron para se ligar a outro átomo. Uma ligação química pode ser uma ligação covalente, uma ligação iônica, uma ligação de hidrogênio ou apenas por causa da força de Van der Waals. Cada um desses laços é atribuído a algum potencial. Esses potenciais criam as interações que mantêm os átomos unidos em moléculas ou cristais. Em muitos compostos simples, a Teoria das Obrigações de Valência, o modelo de Repulsão do Par Elétron da Valência Shell (VSEPR), e o conceito de número de oxidação podem ser usados para explicar a estrutura molecular e a composição. Da mesma forma, teorias da física clássica podem ser usadas para prever muitas estruturas iônicas. Com compostos mais complicados, como complexos metálicos, a teoria das ligações de valência é menos aplicável e as abordagens do alternativo, como a teoria molecular orbital, são geralmente usadas. Ver o diagrama sobre os órbitos eletrônicos. Reação Artigo principal: Reação química Quando uma substância química é transformada em resultado da sua interação com outra substância ou energia, uma reação química terá ocorrido. A reação química é, por conseguinte, um conceito relacionado com a "reação" de uma substância quando esta entra em contato estreito com outra, quer se trate de uma mistura ou de uma solução, de uma exposição a alguma forma de energia, ou de ambas. O resultado é um certo intercâmbio de energia entre os componentes da reação, bem como com o ambiente do sistema, que pode ser um recipiente concebido, que é muitas vezes material de vidro de laboratório. As reações químicas podem resultar na formação ou dissociação de moléculas, ou seja, moléculas se separando para formar duas ou mais moléculas menores, ou rearranjo de átomos dentro ou através de moléculas. As reações químicas geralmente envolvem o fazer ou quebra de ligações químicas. A oxidação, a redução, a dissociação, a neutralização ácido-base e o rearranjo molecular são alguns dos tipos de reações químicas frequentemente utilizados. Uma reação química pode ser representada simbolicamente através de uma equação química. Enquanto numa reação química não nuclear o número e o tipo de átomos em ambos os lados da equação são iguais, para uma reação nuclear isso vale apenas para as partículas nucleares, como prótons e nêutrons. A sequência de etapas em que a reorganização de ligações químicas pode ocorrer ao longo de uma reação química é chamada de seu mecanismo. Pode prever-se uma reação química numa série de etapas, cada uma das quais poderá ter uma velocidade diferente. Muitos intermediários de reação com estabilidade variável podem, assim, ser considerados durante a reação. São propostos mecanismos de reação para explicar a cinética e a mistura relativa de produtos de uma reação. Muitos químicos físicos se especializam em explorar e propor os mecanismos de várias reações químicas. Muitas regras empíricas, como as regras Woodward-Hoffmann, são muitas vezes úteis ao propor um mecanismo de reação química. Segundo o livro de ouro da IUPAC, uma reação química é um processo que resulta na interconversão de espécies químicas." Assim, uma reação química pode ser uma reação elementar ou gradual. É feita uma advertência adicional, na medida em que esta definição inclui capas em que a interconversão de conformadores é observável experimentalmente. Essas reações químicas detectáveis envolvem normalmente conjuntos de entidades moleculares, conforme indicado por esta definição, mas é frequentemente conveniente, do ponto de vista conceptual, utilizar o termo também para alterações que envolvam entidades moleculares solteiros (ou seja, "eventos microscópicos químicos"). Artigo principal do Equilibrium: Equilíbrio químico Embora o conceito de equilíbrio seja amplamente utilizado em todas as ciências, no contexto da química, surge sempre que são possíveis vários estados diferentes da composição química. Por exemplo, numa mistura de vários compostos químicos que podem reagir uns com os outros ou quando uma substância pode estar presente em mais de um tipo de fase. Um sistema de substâncias químicas em equilíbrio, ainda que com composição inalterável não seja muitas vezes estático; as moléculas das substâncias continuam a reagir umas com as outras, dando origem a um equilíbrio dinâmico. Assim, o conceito descreve o estado em que os parâmetros, como a composição química, permanecem inalterados ao longo do tempo. As substâncias químicas presentes nos sistemas biológicos não estão sempre em equilíbrio, as preferencialmentes estão longe de estar em equilíbrio. Artigo principal da energia: Energia No contexto da química, a energia é um atributo de uma substância em consequência da sua estrutura atômica, molecular ou agregada. Uma vez que uma transformação química é acompanhada por uma mudança em um ou mais desses tipos de estrutura, ela é sempre acompanhada por um aumento ou diminuição de energia das substâncias envolvidas. Alguma energia é transferida entre os arredores e os reagentes da reação na forma de calor ou luz; assim, os produtos de uma reação podem ter mais ou menos energia que os reagentes. Diz-se que uma reação é exérgica se o estado final for mais baixo na escala energética do que o estado inicial; no caso de reações endógenas, a situação é inversa. Diz-se que uma reação é exotérmica se a reação liberar calor ao redor; no caso de reações endotermicas, a reação absorve calor do entorno. As reações químicas não são invariavelmente possíveis a menos que os reagentes superem uma barreira de energia conhecida como energia de ativação. A velocidade de uma reação química (a uma dada temperatura T) está relacionada com a energia de ativação E, pelo fator de população de Boltzmann e - E / kT - que é a probabilidade de a molécula ter energia superior ou igual a E à temperatura T indicada. Esta dependência exponencial de uma taxa de reação à temperatura é conhecida como equação de Arrhenius. A energia de ativação necessária para uma reação química pode ser na forma de calor, luz, eletricidade ou força mecânica na forma de ultrassom. Uma energia livre de conceitos, que também incorpora considerações de entropia, é um meio muito útil para prever a viabilidade de uma reação e determinar o estado de equilíbrio de uma reação química, na termodinâmica química. Uma reação só é viável se a variação total da energia livre de Gibbs for negativa, se for igual a zero, a reação química estará em equilíbrio. Existem apenas estados possíveis limitados de energia para elétrons, átomos e moléculas. Essas são determinadas pelas regras da mecânica quântica, que exigem a quantificação da energia de um sistema ligado. Dizem que os átomos/moléculas no estado de energia do mais alto estão excitados. As moléculas/átomos de substância em estado de energia excitada são muitas vezes muito mais reativas, ou seja, mais receptivas a reações químicas. A fase de uma substância é invariavelmente determinada pela sua energia e energia do seu entorno. Quando as forças intermoleculares de uma substância são tais que a energia do ambiente não é suficiente para superá-las, ela ocorre em uma fase mais ordenada como líquido ou sólido como é o caso da água (H2O); um líquido à temperatura ambiente porque suas moléculas estão ligadas por ligações de hidrogênio[43]. Enquanto que o sulfureto de hidrogênio (H2S) é um gás à temperatura ambiente e à pressão padrão, uma vez que as suas moléculas estão ligadas por interações mais fracas entre dipolo e dipolo. A transferência de energia de uma substância química para outra depende do tamanho da quanta de energia emitida por uma substância. No entanto, a energia térmica é muitas vezes transferida mais facilmente de quase qualquer substância para outra porque os fônons responsáveis pelos níveis de energia vibracional e rotativa numa substância têm muito menos energia do que os fótons invocados para a transferência eletrônica de energia. Assim, uma vez que os níveis de energia vibracional e rotativa estão mais próximos do que os níveis de energia eletrônica, o calor é mais facilmente transferido entre substâncias em relação à luz ou a outras formas de energia eletrônica. Por exemplo, a radiação eletromagnética ultravioleta não é transferida com tanta eficácia de uma substância para outra como a energia térmica ou elétrica. A existência de níveis de energia característicos para diferentes substâncias químicas é útil para sua identificação pela análise de linhas espectrais. Na espectroscopia química são frequentemente utilizados diferentes tipos de espectros, por exemplo, IR, micro-ondas, NMR, ESR, etc. A espectroscopia também é usada para identificar a composição de objetos remotos - como estrelas e galáxias distantes - analisando seus espectros de radiação. O termo energia química é muitas vezes utilizado para indicar o potencial de uma substância química sofrer uma transformação por meio de uma reação química ou transformar outras substâncias químicas.
Tradução Automática
Comentários de clientes
4.8 de 5 estrelas24 Total de Comentários
24 Avaliações
Avaliações de produtos similares
5 de 5 estrelas
Por 3 de janeiro de 2023 • Compra segura
Programa de revisão da Zazzle
Material de excelente qualidade e impressão em alta resolução. Excelente qualidade de impressão
Produto original
5 de 5 estrelas
Por 29 de abril de 2019 • Compra segura
Chaveiro Círculo de Metal, 5,08cm
Programa de revisão da Zazzle
Escolhi um chaveiro que faz alusão ao apelido do presenteado. Muito difícil encontrar presentes originais. É só um chaveiro simples; é barato, mas bonito. O importante era poder dar o recado, e o produto é bom e é atraente. O problema é que, por ser importado, custou imposto e embalagens bem acima do próprio produto. Sim, o produto é perfeito. Muito bonito.
5 de 5 estrelas
Por 14 de junho de 2013 • Compra segura
Chaveiro Círculo de Metal, 5,08cm
Revisão do Criador
Excelente compra, tudo certinho!... Recebi a mercadoria embalada de forma que não estragasse o produto!... Muito bom! Impressão perfeita, cores exatas com a imagem original, acabamento sensacional!.. tudo muito bem feito!... Gostei muito!
Tags
Outras Informações
Identificação do Produto (ID): 146259710441158957
Criado em: 10/04/2012 14:02
Avaliação: G
Itens visualizados recentemente