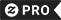Toque/clique na imagem para ver mais RealViewsTM
R$ 199,00
por caneca
Caneca Térmica Eu falo a nomenclatura da química de IUPAC
Quantidade:
Estilo
Caneca de viagem
-R$ 80,00
-R$ 72,00
-R$ 64,00
-R$ 40,00
-R$ 32,00
-R$ 16,00
Tamanho
Cor
Aço inoxidável
Sobre Canecas
Feito por
Sobre Esse Design
Caneca Térmica Eu falo a nomenclatura da química de IUPAC
Química (do árabe: كيمياء Latinized: o chem (kēme), significando o "valor") é a ciência da matéria e das mudanças que se submete. A ciência da matéria é endereçada igualmente pela física, mas quando a física tomar uma aproximação mais geral e mais fundamental, a química é mais especializada, sendo estado relacionado com a composição, o comportamento, a estrutura, e as propriedades da matéria, assim como das mudanças que se submete durante reacções químicas. É uma ciência física para estudos de vários átomos, de moléculas, de cristais e de outros agregados da matéria se no isolamento ou na combinação, que incorporam os conceitos da energia e da entropia com relação à espontaneidade de processos químicos. As disciplinas dentro da química são agrupadas tradicional pelo tipo de matéria que está sendo estudada ou pelo tipo do estudo. Estes incluem a química inorgánica, o estudo da matéria inorgánica; química orgânica, o estudo da matéria orgânica; a bioquímica, o estudo das substâncias encontrou em organismos biológicos; química física, a energia - estudos relacionados de sistemas químicos nas escalas do macro, as moleculars e as submolecular; química analítica, a análise das amostras materiais para ganhar uma compreensão de suas composição quimica e estrutura. Muito mais disciplinas especializadas têm emergido nos últimos anos, por exemplo neurochemistry o estudo químico do sistema nervoso (veja subdisciplines). A química sumária é o estudo científico da interação das substâncias químicas que são constituídas dos átomos ou das partículas subatomic: protão, elétrons e nêutrons. Liga dos átomos para produzir moléculas ou cristais. A química é chamada frequentemente "a ciência central" porque conecta as outras ciências naturais tais como a astronomia, a física, a ciência material, a biologia e a geologia. A génese da química pode ser seguida a determinadas práticas, conhecidas como a alquimia, que tinha sido praticada por diversos milênio em várias partes do mundo, particular o Médio Oriente. A estrutura dos objetos que nós nos usamos geralmente e as propriedades da matéria nós geralmente interagimos com, somos uma conseqüência das propriedades de substâncias químicas e suas interações. Por exemplo, o aço é mais duro do que o ferro porque seus átomos são limitados junto em uma estrutura cristalina mais rígida; a madeira queima ou submete-se à oxidação rápida porque pode reagir espontâneamente com o oxigênio em uma reacção química acima de uma determinada temperatura; o açúcar e o sal dissolvem-se na água porque suas propriedades moleculars/iónicas são tais que a dissolução está preferida sob as circunstâncias ambientais. As transformações que são estudadas na química são um resultado da interação entre substâncias químicas diferentes ou entre a matéria e energia. A química tradicional envolve o estudo das interações entre substâncias em um laboratório de química usando vários formulários de produtos vidreiros de laboratório. O laboratório, instituto da bioquímica da reacção química da água de Colônia A é uma transformação de algumas substâncias em umas ou várias outras substâncias. Pode simbolicamente ser descrito com uma equação química. O número de átomos à esquerda e do direito na equação para uma transformação química é o mais frequentemente igual. A natureza das reacções químicas que uma substância pode se submeter e as mudanças da energia que podem a acompanhar são forçadas por determinadas regras básicas, conhecidas como leis químicas. As considerações da energia e da entropia são invariàvel importantes em quase todos os estudos químicos. As substâncias químicas são classificadas em termos de sua estrutura, de fase assim como de suas composições quimicas. Podem ser analisados usando as ferramentas da análise química, por exemplo espectroscopia e cromatografia. A química é uma parte integrante do currículo da ciência a segundo grau assim como nível adiantado. A estes níveis, é chamado frequentemente "a química geral" que é uma introdução a uma grande variedade de conceitos fundamentais que permitem o estudante de adquirir as ferramentas e as habilidades úteis a níveis avançados, por meio de que a química é estudada invariàvel em algumas de suas várias secundário-disciplinas. Os cientistas, contratados na pesquisa química são sabidos como químicos. A maioria de químicos especializam-se em umas ou várias secundário-disciplinas. Os egípcios antigos da história abriram caminho a arte de sintético "molharam" a química até 4.000 anos há. Por 1000 BC civilizações antigas usavam as tecnologias que formou a base dos vários ramos da química tais como; extraindo o metal de seus minérios, fazendo a cerâmica e os esmaltes, a cerveja da fermentação e o vinho, fazendo pigmentos para cosméticos e pintura, extraindo produtos químicos das plantas para a medicina e perfume, fazendo o queijo, o pano de morte, couro tanning, tornando gordo no sabão, fazendo o vidro, e fazendo ligas gosta do bronze. A génese da química pode ser seguida ao fenômeno extensamente observado de queimar isso conduziu à arte da metalurgia- e à ciência de processar minérios para obter os metais (por exemplo metalurgia em India antigo). A avidez para o ouro conduzido à descoberta do processo para sua purificação, mesmo que os princípios subjacentes não fossem bons compreender-ele era provavelmente uma preferencialmente da transformação do que a purificação. Muitos eruditos naqueles dias pensaram-na razoável para acreditar que existe meios para transformar uns metais (baixos) mais baratos no ouro. Isto levou à alquimia e a busca para a pedra do filósofo que foi acreditada para trazer aproximadamente tal transformação pelo mero atomismo do toque data de 440 BC, como o que pôde ser indicado pelo livro De Rerum Natura (a natureza das coisas) escrito pelo Lucretiusin romano 50 BC. Muito do desenvolvimento adiantado de métodos da purificação é descrito por Plínio a pessoa idosa em seu Naturalis Historia. Um esboço provisório é como segue: 1. A alquimia egípcia [3.000 BCE - 400 BCE], formula cedo teorias do "elemento" tais como o Ogdoad. a alquimia 2 [332 BCE - CE 642], o rei Alexander o excelente conquista Egipto e funda Alexandria, tendo a biblioteca a maior do mundo, onde os eruditos e os homens sábios recolhem para estudar. 3. A alquimia árabe [642 CE - 1200], a conquista muçulmana de Egipto (primeiramente Alexandria); o desenvolvimento do método científico pelo ibn Hayyān de Alhazen e de Jābir revoluciona o campo da química. 4. A casa da sabedoria (árabe: بيتالحكمة; Al-Hikma da isca), al-Andalus (árabe: الأندلس) e Alexandria (árabe: الإسكندرية) transformado as instituições principais do mundo onde os cientistas de todo o religioso e origens étnica trabalharam junto na harmonia que expande os alcances da química em um momento conhecido como a época dourada islâmica. 5. O ibn Hayyān de Jābir, o al-Kindi, o al-Razi, o al-Biruni e Alhazen continuam a dominar o campo da química, dominando a e expandindo os limites do conhecimento e da experimentação. 6. A alquimia européia [1300 - presente], construções pseudo-Geber na química árabe. 7. A química [1661], Boyle escreve a seu texto clássico da química o Chymist céptico. 8. A química [1787], Lavoisier escreve seus elementos clássicos da química. 9. A química [1803], Dalton publica sua teoria atômica. Os pioneiros os mais adiantados da química, e os inventores do método científico moderno, eram eruditos árabes e persas medievais. Introduziram a observação precisa e a experimentação controlada no campo e descobriram substâncias químicas numerosas. [14] a "química como uma ciência foi criada quase pelos muçulmanos; para neste campo, onde os gregos (tanto quanto nós sabemos) foram limitados à experiência industrial e à hipótese vaga, o Saracens introduziu a observação precisa, experiência controlada, e registros cuidadosos. Inventaram e nomearam o alembic (al-anbiq), substâncias inumeráveis quimicamente analisadas, lapidaries compor, centenas distinguidas dos alcalóides e dos ácidos, investigados das suas afinidaoes, estudado e as manufacturados de drogas. A alquimia, que os muçulmanos herdaram de Egipto, contribuiu à química por descobertas de mil incidentes, e por seu método, que era o mais científico de todas as operações medievais." Os químicos muçulmanos os mais influentes eram ibn Hayyān de Jābir (D. 815), al-Kindi (D. 873), al-Razi (D. 925), al-Biruni (D. 1048) e Alhazen (D. 1039). Os trabalhos de Jābir tornaram-se mais de conhecimento geral em Europa com as traduções Latin por um pseudo-Geber na espanha do século XIV, que igualmente escreveu alguns de seus próprios livros sob o nome de caneta "Geber". A contribuição de alquimistas e de metalurgista indianos no desenvolvimento da química era igualmente bastante significativa. A emergência da química em Europa era primeiramente devido à incidência periódica do praga e enferruja lá durante a idade das trevas assim chamada. Isto causou uma necessidade para medicinas. Pensou-se que existe uma medicina universal chamada o elixir de vida que pode curar todas as doenças, mas como a pedra do filósofo, nunca encontrou-se. Para alguns médicos, a alquimia era uma perseguição intelectual, ao longo do tempo, elas obteve melhor nela. Paracelsus (1493-1541), por exemplo, rejeitou a teoria 4 elementar e com somente uma compreensão vaga de seus produtos químicos e medicinas, formada um híbrido da alquimia e ciência em o que devia ser chamada iatrochemistry. Similarmente, as influências dos filósofos tais como o senhor Francis Bacon (1561-1626) e René Descartes (1596-1650), que exigiram mais rigor na matemática e em remover a polarização das observações científicas, conduziu a uma revolução científica. Na química, isto começou com o Robert Boyle (1627-1691), que veio acima com uma equação conhecida como a lei de Boyle sobre as características do estado gasoso. A química veio certamente da idade em que Antoine Lavoisier (1743-1794), tornado a teoria da conservação de massa em 1783; e o desenvolvimento da teoria atômica por John Dalton por volta de 1800. A lei da conservação de massa conduziu à reformulação da química baseada nesta lei e na teoria do oxigênio da combustão, que foi baseada pela maior parte no trabalho de Lavoisier. As contribuições fundamentais de Lavoisier para a química eram um resultado de um esforço consciente para caber todas as experiências na estrutura de uma única teoria. Estabeleceu o uso consistente do equilíbrio químico, usou o oxigênio à derrota a teoria do phlogiston, e desenvolveu um sistema novo de nomenclatura química e fez a contribuição para o sistema métrico moderno. Lavoisier igualmente trabalhou para traduzir a língua arcaica e técnica da química em algo que poderia ser de fácil compreensão pelas massas pela maior parte iletrados, conduzindo a um interesse público aumentado na química. Todos estes avanços na química conduziram a o que é chamado geralmente a revolução química. As contribuições de Lavoisier conduziram a o que é chamado agora a química moderna da química- que é estudada nas instituições educativas pelo mundo inteiro. É devido a estes e a outras contribuições que Antoine Lavoisier está comemorado frequentemente enquanto o "pai da química moderna". [18] A descoberta mais atrasada de Friedrich Wöhler que muitas substâncias naturais, compostos orgânicos, podem certamente ser sintetizadas em um laboratório de química igualmente ajudou a química moderna a amadurecer-se de sua infância. A descoberta dos elementos químicos tem uma longa história dos dias da alquimia e da culminância na descoberta da mesa periódica dos elementos químicos por Dmitri Mendeleev (1834-1907) e umas descobertas mais atrasadas de alguns elementos sintéticos. Artigo principal da etimologia: A química (etimologia) a química da palavra vem do estudo mais adiantado da alquimia, que é um grupo de práticas que abranja elementos da química, da metalurgia, da filosofia, da astrologia, da astronomia, do misticismo e da medicina. A alquimia é derivada por sua vez do significado árabe "valor" do "كيمياء" da palavra, pensa-se geralmente de enquanto a procura para transformar a ligação ou um outro material começar comum no ouro. [21] Esta relação lingüística entre a perseguição do valor e a alquimia é pensada para ter origens egípcias. Muitos acreditam que a palavra árabe a "alquimia" está derivada da palavra Chemi ou Kimi, que são o nome antigo de Egipto no egípcio. [22] [23] [24] a palavra foi pedida subseqüentemente pelos gregos, e dos gregos pelos árabes quando ocuparam Alexandria (Egipto) no século VII. Os árabes adicionaram o artigo definido árabe "al" à palavra, tendo por resultado a palavra (al-kīmiyā). Assim, um alquimista foi chamado um "químico" no discurso popular, e mais tarde o sufixo "- o relé" foi adicionado a este para descrever a arte do químico como a "química". As definições no retrospecto, a definição da química parecem mudar invariàvel por a década, porque as descobertas e as teorias novas adicionam à funcionalidade da ciência. São mostradas abaixo algumas das definições padrão usadas por vários químicos notáveis: • A alquimia (330) - o estudo da composição das águas, movimento, crescimento, personificando, desencarnando, seleccionando os espírito dos corpos e ligando os espírito dentro dos corpos (Zosimos). • Chymistry (1661) - o assunto dos princípios materiais de corpos da mistura (Boyle). • Chymistry (1663) - uma arte científica, por qual aprenda dissolver corpos, e selecciona deles as substâncias diferentes em sua composição, e como uni-las outra vez, e exalta-as a uma perfeição mais alta (Glaser). • Química (1730) - a arte da mistura de resolução, do composto, ou de corpos agregados em seus princípios; e de compr tais corpos daqueles princípios (Stahl). • Química (1837) - a ciência estada relacionada com as leis e os efeitos de forças moleculars (Dumas). • Química (1947) - a ciência das substâncias: sua estrutura, suas propriedades, e as reações que os mudam em outras substâncias (Pauling). • Química (1998) - o estudo da matéria e das mudanças que se submete (Chang). Os conceitos básicos diversos conceitos são essenciais para o estudo da química; alguns deles são: Artigo principal do átomo: O átomo um átomo é a unidade básica de química. Consiste no núcleo carregado da positivamente - (o núcleo atômico) que contêm protão e nêutrons, e que mantem um número de elétrons para equilibrar a carga positiva no núcleo. O átomo é igualmente a entidade a menor que pode ser prevista para reter algumas das propriedades químicas do elemento, tais como o electronegativity, potencial de ionização, preferiu estados de oxidação, número da coordenação, e tipos preferidos de ligações formar (por exemplo, metálico, iónico, covalent). Artigo principal do elemento: O elemento químico o conceito do elemento químico é relacionado àquele da substância química. Um elemento químico é caracterizado por um número particular de protão nos núcleos de seus átomos. Este número é sabido como o número atômico do elemento. Por exemplo, todos os átomos com os 6 protão em seus núcleos são átomos do carbono do elemento químico, e todos os átomos com os 92 protão em seus núcleos são átomos do urânio do elemento. 94 elementos químicos ou tipos diferentes de átomos baseados no número de protão existem naturalmente. Uns 18 mais adicionais foram reconhecidos por IUPAC como existindo artificial somente. Embora todos os núcleos de todos os átomos que pertencem a um elemento tenham o mesmo número de protão, não podem necessariamente ter o mesmo número de nêutrons, tais átomos são denominados isótopos. De facto diversos isótopos de um elemento podem existir. A apresentação a mais conveniente dos elementos químicos está na mesa periódica dos elementos químicos, que agrupa elementos pelo número atômico. Devido a suas arranjo, grupos, ou colunas, e períodos, ou fileiras engenhosos, dos elementos na mesa uma ou outra parte diversas propriedades químicas, ou segue uma determinada tendência nas características tais como o raio atômico, o electronegativity, as lista etc. dos elementos pelo nome, pelo símbolo, e pelo número atômico esteja igualmente disponível. Combine o artigo principal: O composto do composto químico A é uma substância com uma relação particular dos átomos de elementos químicos particulares que determine sua composição, e de uma organização particular que determine propriedades químicas. Por exemplo, a água é um hidrogênio e um oxigênio de contenção composto na relação de dois a um, com o átomo de oxigênio entre os dois átomos de hidrogênio, e um ângulo de 104.5° entre ele. Os compostos são formados e interconverted por reacções químicas. Artigo principal da substância: A substância química química de substância A é um tipo da matéria com uma composição definida e do grupo de propriedades. [33] Restrita o discurso, uma mistura dos compostos, os elementos ou os compostos e os elementos não são uma substância química, mas pode ser chamado um produto químico. A maioria das substâncias que nós encontramos em nosso dia-a-dia são algum tipo da mistura; por exemplo: o ar, as ligas, a biomassa, a nomenclatura etc. das substâncias são uma parte crítica da língua da química. Geralmente refere um sistema nomeando compostos químicos. Mais cedo na história de substâncias da química era o nome dado por seu descobridor, que conduziu frequentemente a algumas confusão e dificuldade. Contudo, hoje o sistema de IUPAC de nomenclatura química permite que os químicos especifiquem pelos compostos específicos conhecidos entre a variedade vasta de produtos químicos possíveis. A nomenclatura padrão de substâncias químicas é ajustada pela união internacional da química pura e aplicada (IUPAC). Há uns sistemas bem definidos no lugar para nomear a espécie química. Os compostos orgânicos são nomeados de acordo com o sistema orgânico da nomenclatura. [34] Os compostos inorgánicos são nomeados de acordo com o sistema inorgánico da nomenclatura. [35] Além o serviço químico dos abstratos planejou um método para posicionar a substância química. Neste esquema cada substância química é identificável por um número conhecido como o número do registro de CAS. Artigo principal da molécula: A molécula da molécula A é a parcela indivisível a menor, além de um átomo, de uma substância química pura que tenha seu grupo original de propriedades químicas, isto é, seu potencial se submeter a um determinado grupo de reacções químicas com outras substâncias. As moléculas podem existir como eletricamente íons desiguais das unidades neutras. As moléculas são tipicamente um grupo de limite dos átomos junto por ligações covalent, tais que a estrutura é eletricamente ponto morto e todos os elétrons do valence estão emparelhados com outros elétrons nas ligações ou em pares solitários. Uma estrutura molecular descreve as ligações e as posições relativas dos átomos em uma molécula tal como aquele em Paclitaxel mostrado aqui uma da característica principal de uma molécula são sua geometria chamada frequentemente sua estrutura. Quando a estrutura de moléculas atômicas diatomic, triatómicas ou tetra puder ser trivial, (etc. piramidal linear, angular) a estrutura das moléculas polyatomic, de que é constituído de mais de seis átomos (de diversos elementos) pode ser crucial para sua natureza química. Artigo principal da toupeira: A toupeira da toupeira (unidade) A é a quantidade de uma substância que contenha tantas como entidades elementares (átomos, moléculas ou íons) porque há átomos em 0,012 quilogramas (ou em 12 gramas) de carbon-12, onde os átomos carbon-12 unbound, em repouso e em seu estado à terra. [36] Este número é sabido como a constante de Avogadro, e determinado empìrica. O valor atualmente aceitado é o × 6,02214179 (de 30) 1023 mol−1 (2007 CODATA). A melhor maneira de compreender o significado do termo "toupeira" é compará-la aos termos tais como dúzia. Apenas porque uma dúzia são igual a 12, uma toupeira é igual (30) ao × 6,02214179 1023. O termo é usado porque é muito mais fácil dizer, por exemplo, 1 toupeira de átomos de carbono, do que ela é dizer 6,02214179 (30) do × átomos 1023 de carbono. Igualmente, nós podemos descrever o número de entidades como um múltiplo ou uma fração de 1 toupeira, por exemplo 2 toupeiras ou 0,5 toupeiras. A toupeira é um número absoluto (não tendo nenhuma unidade) e pode descrever qualquer tipo de objeto elementar, embora o uso da toupeira seja limitado geralmente à medida de estruturas subatomic, atômicas, e moleculars. O número de toupeiras de uma substância em um litro de uma solução é sabido como seu molarity. Molarity é a unidade comum usada para expressar a concentração de uma solução na química física. Íons e artigo principal de sais: O íon um íon é uma espécie carregada, um átomo ou uma molécula, que perca ou ganhe uns ou vários elétrons. Positivamente - cations carregados (por exemplo Na do cation do sódio+) e negativamente - os aníons carregados (por exemplo cloreto Cl−) podem formar uma estrutura cristalina dos sais neutros (por exemplo NaCl do cloreto de sódio). Os exemplos dos íons polyatomic que não racham acima durante reações da ácido-base são o hidróxido (OH−) e o fosfato (PO43−). Os íons na fase gasosa são sabidos frequentemente como o plasma. Artigo principal da acidez e da basicidade: A substância do ácido A pode frequentemente ser classificada como um ácido ou uma base. Isto é feito frequentemente com base em um tipo particular da reação, a saber a troca dos protão entre compostos químicos. Contudo, uma extensão a este modo de classificação foi fabricada cerveja acima pelo químico americano, Gilbert Newton Lewis; neste modo de classificação que a reação não é limitada àquelas que ocorrem em uma solução aquosa, assim é limitado já não às soluções na água. De acordo com o conceito conforme Lewis, as coisas cruciais que estão sendo trocadas são cargas lá são diversas outras maneiras em que uma substância pode ser classificada como um ácido ou uma base, como são evidentes na história deste artigo principal da fase do conceito: Fase (matéria) além do que as propriedades químicas específicas que distinguem os produtos químicos químicos diferentes das classificações podem existir em diversas fases. Geralmente, as classificações químicas são independente destes classificações da fase do volume; contudo, um pouco mais de fases exóticas são incompatíveis com determinadas propriedades químicas. Uma fase é um grupo de estados de um sistema químico que têm propriedades estruturais maiorias similares, sobre uma escala das condições, tais como a pressão ou a temperatura. As propriedades físicas, tais como a densidade e o R.I. tendem a cair dentro dos valores característicos da fase. A fase de matéria é definida pela transição de fase, que é em quando a energia psta ou tomada fora do sistema entra em rearranjar a estrutura do sistema, em vez de mudar as circunstâncias maiorias. Às vezes a distinção entre fases pode ser contínua em vez de ter um limite discreto, a matéria é considerada neste caso para estar em um estado supercrítico. Quando três estados se encontram baseado nas circunstâncias, sabe-se como um ponto triplo e desde que este é invariant, é uma maneira conveniente de definir um grupo de circunstâncias. Os exemplos os mais familiares das fases são sólidos, líquidos, e gáss. Muitas substâncias exibem fases contínuas múltiplas. Por exemplo, há três fases de ferro contínuo (alfa, gama, e delta) que variam baseado na temperatura e na pressão. Uma diferença principal entre fases contínuas é a estrutura de cristal, ou arranjo, dos átomos. Uma outra fase encontrada geralmente no estudo da química é a fase aquosa, que é o estado de substâncias dissolvidas na solução aquosa (isto é, na água). As fases menos familiares incluem plasmas, condensados de Bose-Einstein e condensados fermionic e as fases paramagnéticas e ferromagnetic de materiais magnéticos. Quando a maioria de fases familiares tratarem os sistemas tridimensionais, é igualmente possível definir analogs em sistemas bidimensionais, que recebeu a atenção para sua importância aos sistemas na biologia. Artigo principal dos Redox: Redox é um conceito relativo à capacidade dos átomos de várias substâncias para perder ou ganhar elétrons. As substâncias que têm a capacidade para oxidar outras substâncias seriam oxidativos e são sabidas como agentes, oxidante ou oxidizers de oxidação. Um oxidante remove os elétrons de uma outra substância. Similarmente, as substâncias que têm a capacidade para reduzir outras substâncias seriam redutoras e são sabidas como agentes de diminuição, reductants, ou redutores. Os elétrons reductant de transferências a uma outra substância, e são oxidados assim. E porque "doa" elétrons é chamado igualmente um doador de elétron. A oxidação e a redução referem corretamente uma mudança no númeroque da oxidação transferência real dos elétrons pode nunca ocorrer. Assim, a oxidação é mais bem definida como um aumento no número da oxidação, e a redução como uma diminuição no número da oxidação. Os átomos dos orbitals atômicos e moleculars do elétron da ligação que colam junto nas moléculas ou nos cristais seriam ligados um com o outro. Uma ligação química pode ser visualizada como o equilíbrio multipole entre as cargas positivas nos núcleos e as cargas negativas que oscilam sobre elas. A atração e a repulsa mais do que simples, as energias e as distribuições caracterizam a disponibilidade de um elétron para ligar-se a um outro átomo. Uma ligação química pode ser ou uma ligação covalent, uma ligação iónica, uma ligação de hidrogênio ou apenas devido à força de Van der Waals. Cada um dos estes tipo da ligação é atribuído a algum potencial. Estes potenciais criam as interações que mantêm os átomos unidos nas moléculas ou nos cristais. Em muitos compostos simples, a teoria de ligação de Valence, o modelo da repulsa dos pares do elétron de Shell do Valence (VSEPR), e o conceito do número da oxidação podem ser usados para explicar a estrutura molecular e a composição. Similarmente, as teorias da física clássica podem ser usadas para prever muitas estruturas iónicas. Com os compostos mais complicados, tais como complexos do metal, a teoria de ligação de valence é menos aplicável e os abordagens alternativa, tais como a teoria do orbital molecular, são usados geralmente. Veja o diagrama em orbitals eletrônicos. Artigo principal da reação: A reacção química quando uma substância química é transformada em conseqüência de sua interação com outro ou energia, uma reacção química é dita ter ocorrido. A reacção química é conseqüentemente um conceito relativo à "reação" de uma substância quando vem no contato próximo com outro, se como uma mistura ou uma solução; exposição a algum formulário de energia, ou ambos. Conduz a alguma troca da energia entre os componentes da reação também com o ambiente de sistema que pode ser as embarcações projetadas que são frequentemente produtos vidreiros de laboratório. As reacções químicas podem conduzir à formação ou dissociação das moléculas, isto é, as moléculas que quebram distante para formar moléculas dois ou menores, ou rearranjo dos átomos dentro ou através das moléculas. As reacções químicas envolvem geralmente o fazer ou a quebra de ligações químicas. A oxidação, a redução, a dissociação, a neutralização da ácido-base e o rearranjo molecular são alguns dos tipos de uso geral das reacções químicas. Uma reacção química pode simbolicamente ser descrita com uma equação química. Quando em uma reacção química não-nuclear o número e o tipo dos átomos em ambos os lados da equação forem iguais, para uma reação nuclear este guardara verdadeiro somente para os protão e os nêutrons nucleares das partículas a saber. A seqüência das etapas em que a reorganização de ligações químicas pode ocorrer no curso de uma reacção química é chamada seu mecanismo. Uma reacção química pode ser prevista para ocorrer em um número de etapas, cada qual podem ter uma velocidade diferente. Muitos intermediários da reação com estabilidade variável podem assim ser previstos durante uma reação. Os mecanismos da reação são propor explicar a cinética e a mistura do produto relativo de uma reação. Muitos químicos físicos especializam-se em explorar e em propr os mecanismos de várias reacções químicas. Diversas regras empíricas, como as regras de Woodward-Hoffmann vêm frequentemente acessível ao propr um mecanismo para uma reacção química. De acordo com o livro do ouro de IUPAC uma reacção química é um processo esse resultados no interconversion da espécie química". Em conformidade, uma reacção química pode ser uma reação elementar ou uma reação por etapas. Uma advertência adicional é feita, que esta definição inclui os casos onde o interconversion dos conformers é experimental perceptível. Tais reacções químicas detectáveis envolvem normalmente grupos de entidades moleculars como indicado por esta definição, mas é frequentemente conceptual conveniente usar igualmente o termo para as mudanças que envolvem únicas entidades moleculars (isto é "eventos químicos microscópicos "). Artigo principal do equilíbrio: O equilíbrio químico embora o conceito do equilíbrio seja amplamente utilizado através das ciências, no contexto da química, ele levanta-se sempre que um número de estados diferentes da composição quimica são possíveis. Por exemplo, em uma mistura de diversos compostos químicos que podem reagir um com o outro, ou quando uma substância puder estar atual em mais do que uma amável da fase. Um sistema de substâncias químicas no equilíbrio mesmo que ter uma composição constante não seja o mais frequentemente estático; as moléculas das substâncias continuam a reagir um com o outro assim causando um equilíbrio dinâmico. Assim o conceito descreve o estado em que os parâmetros tais como a composição quimica permanecem inalterados ao longo do tempo. Os produtos químicos atuais em sistemas biológicos não estão invariàvel no equilíbrio, preferencialmente que são longe do equilíbrio. Artigo principal da energia: A energia no contexto da química, energia é um atributo de uma substância em consequência de sua estrutura atômica, molecular ou agregada. Desde que uma transformação química é acompanhada de uma mudança em uns ou vários destes tipos da estrutura, é acompanhada invariàvel de um aumento ou de uma diminuição da energia das substâncias envolvidas. Alguma energia é transferida entre os arredores e os reagentes da reação sob a forma do calor ou a luz; assim os produtos de uma reação podem ter mais ou menos energia do que os reagentes. Uma reação seriam exergonic se o estado final é mais baixo na escala da energia do que o estado inicial; no caso das reações endergonic a situação é o reverso. Uma reação seriam exotérmica se a reação libera o calor aos arredores; no caso das reações endothermic, a reação absorve o calor dos arredores. As reacções químicas não são invariàvel possíveis a menos que os reagentes superarem uma barreira de energia conhecida como a energia de ativação. A velocidade de uma reacção química (na temperatura dada T) é relacionado à energia de ativação E, pelo − E/kT do fator e da população do Boltzmann - de que é a probabilidade da molécula para ter a energia superior ou igual a o E na temperatura dada T. Esta dependência exponencial de uma taxa de reação na temperatura é sabida como a equação de Arrhenius. A energia de ativação necessária para uma reacção química pode ser sob a forma do calor, da luz, da eletricidade ou da força mecânica sob a forma do ultra-som. Uma energia livre do conceito relacionado, que igualmente incorpore considerações da entropia, é meios muito úteis para prever a possibilidade de uma reação e determinar o estado de equilíbrio de uma reacção química, no termodinâmica químico. Uma reação é praticável somente se a mudança total na energia livre de Gibbs é negativa, se é igual a zero a reacção química seriam no equilíbrio. Existe somente estados possíveis limitados de energia para elétrons, átomos e moléculas. Estes são determinados pelas regras de mecânicos de quantum, que exigem a quantização da energia de um sistema encadernado. Os átomos/moléculas em um estado de energia mais alta seriam excited. As moléculas/átomos da substância em um estado de energia excited são frequentemente muito mais reactivos; isto é, mais favorável às reacções químicas. A fase de uma substância é determinada invariàvel por sua energia e pela energia de seus arredores. Quando as forças intermolecular de uma substância são tais que a energia dos arredores não é suficiente para os superar, ocorre em uma fase mais pedida como o líquido ou o sólido como é o caso com a água (H2O); um líquido na temperatura ambiente porque suas moléculas são limitadas por ligações de hidrogênio. [43] Considerando que o sulfureto de hidrogênio (H2S) é um gás na temperatura ambiente e na pressão padrão, porque suas moléculas são limitadas por umas interações mais fracas do dipolo-dipolo. Transferência de energia de uma substância química a outra depende do tamanho dos quantum de energia emissores de uma substância. Contudo, a energia calorífica é transferida frequentemente mais facilmente de quase toda a substância a outra porque os fonão responsáveis para níveis de energia vibracional e rotatória em uma substância têm muito menos energia do que os fotão invocados para transferência de energia eletrônica. Assim, porque os níveis de energia vibracional e rotatória são mais fechados do que níveis de energia eletrônica, o calor é transferido mais facilmente entre a luz relativa a das substâncias ou os outros formulários da energia eletrônica. Por exemplo, a radiação eletromagnética ultravioleta não é transferida com tanta eficácia de uma substância a outra como a energia térmica ou elétrica. A existência de níveis de energia característicos para substâncias químicas diferentes é útil para sua identificação pela análise de linhas espectrais. Os tipos diferentes dos espectros são usados frequentemente na espectroscopia química, a espectroscopia por exemplo do IR, da microonda, a NMR, do ESR, etc. é usada igualmente para identificar a composição de objetos remotos - como estrelas e galáxias distantes - analisando seus espectros da radiação. A energia química do termo é usada frequentemente indicar o potencial de uma substância química submeter-se a uma transformação com uma reacção química ou transformar outras substâncias químicas.
Tradução Automática
Comentários de clientes
4.7 de 5 estrelas77 Total de Comentários
77 Avaliações
Avaliações de produtos similares
5 de 5 estrelas
Por 7 de dezembro de 2017 • Compra segura
Caneca de viagem, 444 ml
Programa de revisão da Zazzle
Realmente demorou um pouco a chegar, mas valeu a pena a espera!
Design ótimo, foi além da minha expectativa!
Super recomendo sim!!! Impressão ficou perfeita!
5 de 5 estrelas
Por 28 de dezembro de 2016 • Compra segura
Caneca de viagem, 444 ml
Programa de revisão da Zazzle
Nota 10! Chegou no tempo exato previsto, chegou tudo conforme o combinado, exatamente igual a foto! Arrasaram! As cores estão exatamente igual a foto, o tamanho ótimo. Parabéns
5 de 5 estrelas
Por 6 de novembro de 2017 • Compra segura
Caneca de viagem, 444 ml
Programa de revisão da Zazzle
Produto de excelente qualidade. Nunca vi uma impressão tão boa como essa, recomendo!!! Sem nenhum defeito e nenhuma mancha. Impecável.
Tags
Outras Informações
Identificação do Produto (ID): 168264238593000131
Criado em: 10/04/2012 14:02
Avaliação: G
Itens visualizados recentemente