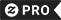Toque/clique na imagem para ver mais RealViewsTM
R$ 116,00
por cada camiseta
Camiseta im nao preguiçoso eu apenas não tenho bastante
Quantidade:
Estilo
Camiseta Básica
-R$ 7,00
+R$ 47,00
Cor e processo de impressão
Branco
Impressão clássica: sem camada de base
+R$ 5,70
+R$ 5,70
+R$ 5,70
+R$ 5,70
+R$ 5,70
+R$ 5,70
+R$ 5,70
+R$ 5,70
+R$ 5,70
+R$ 5,70
+R$ 5,70
+R$ 5,70
+R$ 5,70
Impressão intensa: com camada de base
+R$ 28,35
+R$ 28,35
+R$ 28,35
+R$ 28,35
+R$ 28,35
+R$ 28,35
+R$ 28,35
+R$ 28,35
+R$ 28,35
+R$ 28,35
+R$ 28,35
+R$ 28,35
+R$ 28,35
Sobre Camisetas
Feito por
Sobre Esse Design
Camiseta im nao preguiçoso eu apenas não tenho bastante
As enzimas são as proteínas que catalisam (isto é, aumente as taxas de) reacções químicas. [1] [2] em reações enzimáticos, as moléculas no início do processo são chamadas carcaças, e a enzima converte-as nas moléculas diferentes, chamadas os produtos. Quase todos os processos em uma pilha biológica precisam enzimas de ocorrer em taxas significativas. Desde que as enzimas são seletivas para suas carcaças e aceleram somente algumas reações entre de muitas possibilidades, o grupo de enzimas feitas em uma pilha determina que caminhos metabólicos ocorrem nessa pilha. Como todos os catalizadores, as enzimas trabalham abaixando a energia de ativação (‡ do Ea) para uma reação, assim dramàtica aumentando a taxa da reação. Em conseqüência, os produtos são formados mais rapidamente e as reações alcançam seu estado de equilíbrio mais ràpida. A maioria de taxas de reação da enzima são milhões de épocas mais rapidamente do que aquelas de reações un-catalisadas comparáveis. Como com todos os catalizadores, as enzimas não são consumidas pelas reações que catalisam, nem alteram o equilíbrio destas reações. Contudo, as enzimas diferem da maioria outros de catalizadores sendo muito mais específicas. As enzimas são sabidas para catalisar aproximadamente 4.000 reações bioquímicas. [3] Algumas moléculas do RNA chamadas ribozymes igualmente catalisam reações, com um exemplo importante que é algumas peças do ribosome. [4] [5] moléculas sintéticas chamaram enzimas artificiais igualmente indicam enzima-como a catálise. [6] A atividade de enzima pode ser afetada por outras moléculas. Os inibidores são as moléculas que diminuem a atividade de enzima; os activadores são as moléculas que aumentam a atividade. Muitos drogas e venenos são inibidores de enzima. A atividade é afetada igualmente pela temperatura, pelo ambiente químico (por exemplo, pH), e pela concentração de carcaça. Algumas enzimas são usadas comercialmente, por exemplo, na síntese dos antibióticos. Além, alguns produtos do agregado familiar usam enzimas para acelerar reações bioquímicas (por exemplo, as enzimas em pós de lavagem biológicos dividem a proteína ou manchas gordas na roupa; as enzimas em tenderizers da carne dividem as proteínas, facilitando a carne mastigar). Os índices [couro cru] 1 estrutura da etimologia e da história 2 e especificidade 2.1.1" dos mecanismos 2,1 fechamento e chave" modelam 2,2 mecanismos 2.2.1 dinâmicas da estabilização 2.2.2 do estado de transição e controles biológicos Allosteric da função 8 da inibição 7 da cinética 6 do termodinâmica 5 das coenzima 4 dos cofactor da modulação os 3 da função 2,3 e dos cofactor 3,2 das coenzima 3,1 da participação da atividade 9 em convenções de nomeação da doença 10 11 aplicações industriais 12 consideram igualmente uma etimologia de 13 relações externas da leitura adicional 15 das referências 14 [edite] e a história Eduard BuchnerAs cedo como o 18o atrasado e os inícios do século XIX, a digestão da carne pelas secreções do estômago [7] e a conversão do amido aos açúcares por extratos e por saliva da planta foram sabidos. Contudo, o mecanismo por que este ocorreu não tinha sido identificado. [8] No século XIX, ao estudar a fermentação do açúcar ao álcool pelo fermento, Louis Pasteur veio à conclusão que esta fermentação estêve catalisada por uma força vital contida dentro das pilhas de fermento chamadas os "fermento", que foram pensados para funcionar somente dentro dos organismos vivos. Escreveu que "a fermentação alcoólica é um ato correlacionado com a vida e a organização das pilhas de fermento, não com a morte ou a putrefacção das pilhas. " [9] em 1877, o fisiologista alemão Wilhelm Kühne (1837-1900) usou primeiramente a enzima do termo, que vem do ενζυμον, "na levedura", para descrever este processo. [10] A enzima da palavra foi usada mais tarde para referir substâncias nonliving tais como o pepsin, e o fermento da palavra foi usado para referir a atividade química produzida por organismos de vida. Em 1897, Eduard Buchner submeteu seu primeiro papel na capacidade dos extratos de fermento que faltaram todas as pilhas de fermento vivas para fermentar o açúcar. Em uma série de experiências no de Berlim, encontrou que o açúcar estêve fermentado mesmo quando não havia nenhuma pilha de fermento viva na mistura. [11] Nomeou a enzima que causou a fermentação da sacarina "zymase". [12] Em 1907, recebeu o prémio nobel na química "para sua pesquisa bioquímica e sua descoberta da fermentação sem célula". Depois do exemplo de Buchner, as enzimas são nomeadas geralmente de acordo com a reação que se realizam. Tipicamente, para gerar o nome de uma enzima, o sufixo - o ase é adicionado ao nome de sua carcaça (por exemplo, a lactase é a enzima que fende a lactose) ou do tipo de reação (por exemplo, a polimerase de ADN forma polímeros do ADN). [13] Mostrando que as enzimas poderiam funcionar fora de uma pilha viva, o passo seguinte era determinar sua natureza bioquímica. Muitos trabalhadores adiantados notaram que a atividade enzimático estêve associada com as proteínas, mas diversos cientistas (tais como o Prémio Nobel Richard Willstätter) discutiram que as proteínas eram meramente portadores para as enzimas verdadeiras e que as proteínas por si mesmo eram incapazes da catálise. Contudo, em 1926, James B. Sumner mostrou que o urease da enzima era uma proteína pura e cristalizado lhe; Sumner fez do mesmo modo para o catalase da enzima em 1937. A conclusão que as proteínas puras podem ser enzimas foi provada definitiva por Northrop e por Stanley, que trabalharam no pepsin das enzimas digestivas (1930), no trypsin e na quimotripsina. Estes três cientistas foram concedidos o prémio nobel 1946 na química. [14] Esta descoberta que as enzimas poderiam ser cristalizadas eventualmente permitiu que suas estruturas fossem resolvidas pelo cristalografia do raio X. Este era primeiro feito para o lysozyme, uma enzima encontrada em lágrimas, o saliva e as claras de ovos que digere o revestimento de algumas bactérias; a estrutura foi resolvida por um grupo conduzido por David Chilton Phillips e publicado em 1965. [15] Esta estrutura de alta resolução do lysozyme marcou o começo do campo da biologia estrutural e do esforço compreender como as enzimas trabalham a nível atômico de detalhe. [edite] as estruturas e os mecanismos consideram igualmente: Diagrama da fita da catálise da enzima que mostra a anidrose carbónica humana II. A esfera cinzenta é o cofactor do zinco no local ativo. O diagrama seleccionado de PDB 1MOO.Enzymes é geralmente proteínas globular e varia de apenas 62 resíduos do ácido aminado em tamanho, para o monómero de um tautomerase de 4 oxalocrotonate, [16] sobre a 2.500 resíduos na sintase animal do ácido gordo. [17] Um pequeno número de catalizadores biológicos RNA-baseados existem, com ser o mais comum o ribosome; estes são referidos como RNA-enzimas ou ribozymes. As atividades das enzimas são determinadas por sua estrutura tridimensional. [18] Contudo, embora a estrutura determine a função, prever uma atividade de enzima nova apenas de sua estrutura é um problema muito difícil que não seja resolvido ainda. [19] A maioria de enzimas são muito maiores do que as carcaças que actuam sobre, e somente uma parcela pequena da enzima (ao redor 3-4 ácidos aminados) é envolvida diretamente na catálise. [20] A região que contem estes resíduos catalíticos, liga a carcaça, e realiza então a reação é sabida como o local ativo. As enzimas podem igualmente conter os locais que ligam os cofactor, que são necessários para a catálise. Algumas enzimas igualmente têm locais obrigatórios para as moléculas pequenas, que são frequentemente produtos ou carcaças diretas ou indiretas da reação catalisada. Este emperramento pode servir para aumentar ou diminuir a atividade de enzima, prever meios o regulamento de feedback. Como todas as proteínas, as enzimas são correntes longas, lineares dos ácidos aminados que se dobram para produzir um produto tridimensional. Cada seqüência de ácido aminado original produz uma estrutura específica, que tenha propriedades originais. As correntes individuais da proteína podem às vezes agrupar junto para formar um complexo da proteína. A maioria de enzimas podem ser desnaturar-que é, unfolded e inactivated-pelos desnaturalizadores do aquecimento ou do produto químico, que interrompem a estrutura tridimensional da proteína. Segundo a enzima, a desnaturação pode ser reversível ou irreversível. As estruturas das enzimas no complexo com carcaças ou nos analogs da carcaça durante uma reação podem ser obtidas usando métodos resolvidos tempo do cristalografia. [edite] as enzimas da especificidade são geralmente muito específicas a respeito de que reações catalisam e as carcaças que são envolvidas nestas reações. A forma complementar, a carga e características hidrófilas/hidrofóbicas das enzimas e das carcaças são responsáveis para esta especificidade. As enzimas podem igualmente mostrar níveis impressionantes de stereospecificity, de regioselectivity e de chemoselectivity. [21] Algumas das enzimas que mostram a especificidade e a precisão as mais altas são envolvidas no copi e na expressão do genoma. Estas enzimas têm mecanismos da "prova-leitura". Aqui, uma enzima tal como a polimerase de ADN catalisa uma reação em uma primeira etapa e então em verificações que o produto é num segundo etapa correta. [22] Este processo da dois-etapa conduz às taxas de erro médio de menos de 1 erro em 100 milhão reações em polimerases mamíferas da alta fidelidade. [23] Os mecanismos de correcção similares são encontrados igualmente na polimerase de RNA, [24] synthetases do tRNA do aminoacyl [25] e ribosomes. [26] Algumas enzimas que produzem metabolitos secundários são descritas como promíscuos, porque podem actuar em uma escala relativamente larga de carcaças diferentes. Sugeriu-se que esta especificidade larga da carcaça fosse importante para a evolução de caminhos biossintéticos novos. [27] [edite] o "fechamento e" as enzimas modelo chaves são muito específicos, e foi sugerido pelo químico orgânico Emil Fischer do Prémio Nobel em 1894 que este fosse porque a enzima e a carcaça possuem as formas geométricas complementares específicas que cabem exatamente em uma outra. [28] Isto é referido frequentemente como "o modelo do fechamento e da chave". Contudo, quando este modelo explicar a especificidade da enzima, não explica a estabilização do estado de transição que as enzimas conseguem. Diagramas para mostrar a hipótese apta induzida da ação de enzima. Em 1958, Daniel Koshland sugeriu uma alteração ao modelo de fechamento e chave: desde que as enzimas são estruturas flexíveis da preferencialmente, o local ativo está remodelado continuamente por interações com a carcaça enquanto a carcaça interage com a enzima. [29] Em conseqüência, a carcaça não liga simplesmente a um local ativo rígido; as correntes laterais do ácido aminado que compo o local ativo são moldadas nas posições precisas que permitem a enzima de executar sua função catalítica. Em alguns casos, como glycosidases, a molécula da carcaça igualmente deforma leve enquanto entra no local ativo. [30] O local ativo continua a mudar até que a carcaça esteja limitada completamente, que no ponto a forma e a carga finais são determinadas. [31] O ajustado induzido pode aumentar a fidelidade do reconhecimento molecular na presença da competição e do ruído através do mecanismo de correcção conformational. [32] [edite] as enzimas dos mecanismos podem actuar em diversas maneiras, que abaixam o ‡ de ΔG: [33] Abaixar a energia de ativação criando um ambiente em que o estado de transição é estabilizado (por exemplo esticando a forma da carcaça-por ligar a conformação do transição-state das moléculas da carcaça/produto, a enzima distorce as carcaças encadernadas em seu formulário do estado de transição, reduzindo desse modo a quantidade de energia exigida para terminar a transição). Abaixando a energia do estado de transição, mas sem distorcer a carcaça, criando um ambiente com a distribuição de carga oposta àquela do estado de transição. Fornecendo um caminho alternativo. Por exemplo, temporariamente reagindo com a carcaça para formar um complexo intermediário do ES, que fosse impossível na ausência da enzima. Reduzindo a entropia da reação mude trazendo carcaças junto na orientação correta para reagir. Considerar o ‡ de ΔH sozinho negligencia este efeito. Os aumentos nas temperaturas aceleram reações. Assim, os aumentos da temperatura ajudam a enzima a funcionar mesmo mais rapidamente e desenvolver o produto acabado. Contudo, se heated demasiado, a forma da enzima deteriora-se e somente quando a temperatura vem para trás ao normal faz o regain da enzima sua forma. Algumas enzimas como enzimas thermolabile trabalham melhor em baixas temperaturas. Interessante, este efeito entrópico envolve a desestabilização do estado à terra, [34] e sua contribuição para a catálise é relativamente pequena. [35] [edite] a estabilização do estado de transição a compreensão da origem da redução do ‡ de ΔG exige um encontrar como as enzimas podem estabilizar seu estado de transição mais do que o estado de transição da reação uncatalyzed. Aparentemente, a maioria de modo eficaz para alcançar a grande estabilização é o uso de efeitos eletrostáticos, em particular, tendo um ambiente polar relativamente fixo que seja orientado para a distribuição de carga do estado de transição. [36] Tal ambiente não existe na reação uncatalyzed na água. [edite] a dinâmica e a função consideram igualmente: A dinâmica da proteína a dinâmica interna das enzimas é ligada a seu mecanismo da catálise. [37] [38] [39] dinâmicas internas são o movimento das partes da estrutura da enzima, tais como resíduos individuais do ácido aminado, um grupo de ácidos aminados, ou mesmo um domínio inteiro da proteína. Estes movimentos ocorrem nos vários calendários que variam dos femtosegundos aos segundos. As redes de resíduos da proteína durante todo a estrutura de uma enzima podem contribuir à catálise com os movimentos dinâmicos. [40] [41] [42] [43] movimentos da proteína são vitais a muitas enzimas, mas se as vibrações pequenas e rápidas, ou os movimentos conformational maiores e mais lentos são mais importantes dependem do tipo de reação envolvido. Contudo, embora estes movimentos sejam importantes em ligar e em liberar carcaças e produtos, não é claro se os movimentos da proteína ajudam a acelerar as etapas químicas em reações enzimáticos. [44] Estas introspecções novas igualmente têm implicações em compreender efeitos allosteric e em desenvolver drogas novas. [edite] transição Allosteric da modulação Allosteric de uma enzima entre estados de R e de T, estabilizada por um agonista, por um inibidor e por um artigo principal da carcaça (o modelo de MWC): Os locais Allosteric regulamentares Allosteric são os locais na enzima que ligam às moléculas no ambiente celular. Os locais formam ligações fracas, noncovalent com estas moléculas, causando uma mudança na conformação da enzima. Esta mudança na conformação traduz ao local ativo, que afeta então a taxa de reação da enzima. [45] As interações Allosteric podem inibir e ativar enzimas e são uma maneira comum que as enzimas estão controladas no corpo. [46] [edite] cofactor e artigos principais das coenzima: Os cofactor do cofactor (bioquímica) e da coenzima [edite] algumas enzimas não precisam nenhuns componentes adicionais de mostrar a atividade completa. Contudo, outro exigem as moléculas da não-proteína chamadas cofactor ser limitados para a atividade. [47] Os cofactor podem ser compostos inorgánicos (por exemplo, íons do metal e conjuntos do ferro-enxofre) ou orgânicos (por exemplo, flavin e heme). Os cofactor orgânicos podem ser um ou outro grupos protéticos, que são limitados firmemente a uma enzima, ou coenzima, que são liberadas do local ativo da enzima durante a reação. As coenzima incluem o NADH, o NADPH e o triphosphate de adenosina. Estas moléculas transferem grupos químicos entre enzimas. [48] Um exemplo de uma enzima que contenha um cofactor é anidrose carbónica, e é mostrado no diagrama da fita acima com um cofactor do zinco limitado como parte de seu local ativo. [49] Estas moléculas firmemente limitadas geralmente são encontradas no local ativo e envolvidas na catálise. Por exemplo, o flavin e os cofactor do heme são envolvidos frequentemente em reações dos redox. As enzimas que exigem um cofactor mas não têm um limite são chamadas apoenzymes ou apoproteínas. Um apoenzyme junto com seus cofactor é chamado um holoenzyme (este é o formulário ativo). A maioria de cofactor não são unidos covalently a uma enzima, mas são limitados muito firmemente. Contudo, os grupos protéticos orgânicos podem covalently ser limitados (por exemplo, pirofosfato do thiamine na desidrogenase do piruvato da enzima). O termo "holoenzyme" pode igualmente ser aplicado às enzimas que contêm subunidades múltiplas da proteína, tais como as polimerases de ADN; aqui o holoenzyme é o complexo completo que contem todas as subunidades necessários para a atividade. [edite] as coenzima queenchem o modelo da coenzima NADHCoenzymes são as moléculas orgânicas pequenas que transportam grupos químicos de uma enzima a outra. [50] Alguns destes produtos químicos tais como a riboflavina, o thiamine e o ácido fólico são vitaminas (os compostos que não podem ser sintetizados pelo corpo e devem ser adquiridos da dieta). Os grupos químicos levados incluem o íon do hidruro (h) levado pelo NAD ou pelo NADP+, o grupo do fosfato levou pelo triphosphate de adenosina, pelo grupo do acetil levado pela coenzima A, pelo formyl, pelo methenyl ou pelos grupos metílicos levados pelo ácido fólico e pelo grupo metílico levado por S-adenosylmethionine. Desde que as coenzima são mudadas quimicamente em consequência da ação de enzima, é útil considerar coenzima para ser uma classe especial de carcaças, ou segundas carcaças, que são comuns a muitas enzimas diferentes. Por exemplo, aproximadamente 700 enzimas são sabidas para usar a coenzima NADH. [51] As coenzima geralmente continuamente são regeneradas e suas concentrações são mantidas a nível constante dentro da pilha: por exemplo, NADPH é regenerado com o caminho e o S-adenosylmethionine do fosfato do pentose pelo adenosyltransferase da metionina. Esta regeneração contínua significa que mesmo as pequenas quantidades de coenzima estão usadas muito intensiva. Por exemplo, o corpo humano vira seu próprio peso no ATP cada dia. [52] [edite] termodinâmica as energias dos palcos de uma reacção química. As carcaças precisam muita energia de alcançar um estado de transição, que deteriore então em produtos. A enzima estabiliza o estado de transição, reduzindo a energia necessário aos produtos do formulário. Artigos principais: A energia de ativação, o equilíbrio termodinâmica, e o equilíbrio químico como todos os catalizadores, enzimas não alteram a posição do equilíbrio químico da reação. Geralmente, na presença de uma enzima, a reação funciona no mesmo sentido que sem a enzima, apenas mais rapidamente. Contudo, na ausência da enzima, outro uncatalyzed possível, reações "espontâneas" pôde conduzir aos produtos diferentes, porque naquelas circunstâncias este produto diferente é formado mais rapidamente. Além disso, as enzimas podem acoplar dois ou mais reações, de modo que uma reação thermodynamically favorável possa ser usada "para conduzir" thermodynamically desfavorável. Por exemplo, a hidrólise do ATP é usada frequentemente conduzir outras reacções químicas. [53] As enzimas catalisam as reações dianteiras e inversas ingualmente. Não alteram o equilíbrio próprio, mas somente a velocidade em que é alcançado. Por exemplo, a anidrose carbónica catalisa sua reação em um ou outro sentido segundo a concentração de seus reagentes. (nos tecidos; concentração alta do CO2) (nos pulmões; a baixa concentração do CO2) não obstante, se o equilíbrio é deslocado extremamente em um sentido, isto é, em uma reação muito exergonic, a reação é eficazmente irreversível. Sob estas condições a enzima, de facto, simplesmente catalise a reação no sentido thermodynamically permitido. [edite] artigo principal da cinética: O mecanismo da cinética da enzima para uma única enzima da carcaça catalisou a reação. A enzima (e) liga uma carcaça (s) e produz um produto (a cinética de P).Enzyme é a investigação de como as enzimas ligam carcaças e as transformam em produtos. Os dados da taxa usados em análises cinéticas são obtidos dos ensaios de enzima. Em 1902 o vencedor Henri [54] props uma teoria quantitativa da cinética da enzima, mas seus dados experimentais não era útil porque o significado da concentração de íon de hidrogênio não foi apreciado ainda. Depois que Peter Lauritz Sørensen tinha definido a pH-escala logarítmica e introduzido o conceito da protecção em 1909 [55] o químico alemão Leonor Michaelis e seu postdoc canadense Maud Leonora Menten repetiram as experiências de Henri e confirmaram sua equação que é referida como a cinética de Henri-Michaelis-Menten (às vezes também cinética de Michaelis-Menten). [56] Seu trabalho foi desenvolvido mais por G.E. Briggs e por J.B.S. Haldane, que derivaram as equações cinéticas que são ainda amplamente utilizadas hoje. [57] A contribuição principal de Henri era pensar de reações de enzima em dois palcos. No primeiro, a carcaça liga reversìvel à enzima, formando o complexo da enzima-carcaça. Isto é chamado às vezes o complexo de Michaelis. A enzima então catalisa a etapa química na reação e libera o produto. A curva da saturação para uma reação de enzima que mostra a relação entre a concentração da carcaça (s) e a taxa (v).Enzymes pode catalisar até diverso milhão reações o por segundo. Por exemplo, o decarboxylation uncatalyzed do orotidine 5' - o monophosphate tem uma meia-vida de 78 milhão anos. Contudo, quando o orotidine 5' da enzima - o decarboxylase do fosfato é adicionado, o mesmo processo toma apenas 25 milissegundos. [58] As taxas da enzima dependem das condições da solução e da concentração da carcaça. As circunstâncias que desnaturam a proteína abolem a atividade de enzima, tal como altas temperaturas, extremos do pH ou concentrações altas de sal, ao levantar a concentração da carcaça tendem a aumentar a atividade. Para encontrar a velocidade máxima de uma reação enzimático, a concentração da carcaça é aumentada até que uma taxa constante de formação do produto esteja considerada. Isto é mostrado na curva da saturação à direita. A saturação acontece porque, enquanto a concentração da carcaça aumenta, da enzima livre é convertido cada vez mais no formulário do ES do carcaça-limite. Na velocidade máxima (Vmax) da enzima, todos os locais ativos da enzima são limitados à carcaça, e a quantidade de complexo do ES é a mesma que a quantidade total de enzima. Contudo, Vmax é somente uma constante cinética das enzimas. A quantidade de carcaça necessário para conseguir uma taxa dada de reação é igualmente importante. Isto é dado pela constante de Michaelis-Menten (quilômetro), que é a concentração da carcaça exigida para que uma enzima alcance um meio da sua velocidade máxima. Cada enzima tem um quilômetro característico para uma carcaça dada, e esta pode mostrar como firmemente o emperramento da carcaça é à enzima. Uma outra constante útil é o kcat, que é o número de moléculas da carcaça seguradas por um por segundo ativo do local. A eficiência de uma enzima pode ser expressada em termos de kcat/Km. Isto igualmente é chamado a especificidade constante e incorpora as constantes da taxa para todas as etapas na reação. Porque a constante da especificidade reflete a afinidade e a capacidade catalítica, é útil para comparar enzimas diferentes entre si, ou a mesma enzima com as carcaças diferentes. O máximo teórico para a constante da especificidade é chamado o limite da difusão e é aproximadamente 108 a 109 (M−1 s−1). Neste momento cada colisão da enzima com sua carcaça conduzirá à catálise, e a taxa de formação do produto não é limitada pela taxa de reação mas pela taxa da difusão. As enzimas com esta propriedade são chamadas catalìtica perfeitas ou cinètica perfeitas. O exemplo de tais enzimas é isomerase do triose-fosfato, anidrose carbónica, acetylcholinesterase, catalase, fumarase, β-lactamase, e dismutase do superoxide. A cinética de Michaelis-Menten confia na lei da ação maciça, que é derivada das suposições da difusão livre e da colisão aleatória thermodynamically conduzida. Contudo, muitos processos bioquímicos ou celulares afastam-se significativamente destas circunstâncias, devido à aglomeração macromolecular, à fase-separação da enzima/carcaça/produto, ou a um ou movimento molecular bidimensional. [59] Nestas situações, uma cinética de Michaelis-Menten do fractal pode ser aplicada. [60] [61] [62] [63] algumas enzimas operam-se com cinéticas que são mais rápidas do que as taxas da difusão, que pareceriam ser impossíveis. Diversos mecanismos foram invocados para explicar este fenômeno. Algumas proteínas são acreditadas para acelerar a catálise tirando sua carcaça dentro e pre-orientando os usando campos elétricos dipolar. Outros modelos invocam uma explicação quantum-mecânica da escavação de um túnel, por meio de que um protão ou um elétron podem escavar um túnel através das barreiras da ativação, embora para o protão escavar um túnel este modelo permaneça um tanto controversa. [64] [65] quantum que escavam um túnel para protão foram observados no tryptamine. [66] Isto sugere que a catálise da enzima possa mais exatamente ser caracterizada como "através a preferencialmente da barreira" do que o modelo tradicional, que exige carcaças ir "sobre" uma barreira de energia abaixada. [edite] os inibidores competitivos da inibição ligam reversìvel à enzima, impedindo o emperramento da carcaça. Por outro lado, a ligação da carcaça impede a ligação do inibidor. A carcaça e o inibidor competem para a enzima. Tipos de inibição. Esta classificação foi introduzida por W.W. Cleland. [67] Artigo principal: As taxas de reação da enzima do inibidor de enzima podem ser diminuídas por vários tipos de inibidores de enzima. A inibição competitiva na inibição competitiva, o inibidor e a carcaça competem para a enzima (isto é, não pode ligar ao mesmo tempo). [68] Os inibidores frequentemente competitivos assemelham-se fortemente à carcaça real da enzima. Por exemplo, o methotrexate é um inibidor competitivo do reductase do dihydrofolate da enzima, que catalisa a redução do dihydrofolate ao tetrahydrofolate. A similaridade entre as estruturas do ácido fólico e esta droga é mostrada na figura à parte inferior direita. Note que a ligação do inibidor não precisa de ser ao local obrigatório da carcaça (como indicado freqüentemente), se a ligação do inibidor muda a conformação da enzima para impedir a carcaça que liga e vice-versa. Na inibição competitiva a velocidade máxima da reação não é mudada, mas umas concentrações mais altas da carcaça são exigidas para alcançar uma velocidade dada, aumentando o quilômetro aparente. Inibição não competitiva na inibição que não competitiva o inibidor não pode ligar à enzima livre, mas somente ao ES-complexo. O EIS-complexo formado assim é enzymatically inativo. Este tipo de inibição é raro, mas pode ocorrer em enzimas multimeric. os inibidores Não-competitivos da inibição Não-competitiva podem ligar à enzima ao mesmo tempo que a carcaça, isto é nunca ligam ao local ativo. Os complexos do EI e do EIS são enzymatically inativos. Porque o inibidor não pode ser conduzido da enzima por uma concentração mais alta da carcaça (em contraste com a inibição competitiva), o Vmax aparente muda. Mas porque a carcaça pode ainda ligar à enzima, o quilômetro permanece o mesmos. A inibição misturada este tipo de inibição assemelha-se ao não-competitivo, salvo que o EIS-complexo tem a atividade enzimático residual. Em muitos inibidores dos organismos pode actuar como parte de um mecanismo de feedback. Se uma enzima produz demasiada de uma substância no organismo, essa substância pode actuar como um inibidor para a enzima no início do caminho que a produz, fazendo com que a produção da substância retarde ou pare quando há uma suficiente quantidade. Este é um formulário da reacção negativa. As enzimas que são sujeitas a este formulário do regulamento são frequentemente multimeric e têm locais obrigatórios allosteric para substâncias reguladoras. Seus carcaça/lotes da velocidade é não hyperbolar, mas sigmoidal (S-dado forma).
Tradução Automática
Store
Comentários de clientes
4.2 de 5 estrelas276 Total de Comentários
276 Avaliações
Avaliações de produtos similares
5 de 5 estrelas
Por 2 de setembro de 2021 • Compra segura
Camiseta Básica, Branco, Adulto G
Revisão do Criador
Gostei das cores, do tecido e do tamanho, a estampa saiu bem. Impressão não desfocou imagem e respeitou a cor, ótimo
5 de 5 estrelas
Por 23 de janeiro de 2014 • Compra segura
Camiseta Básica, Branco, Adulto G
Programa de revisão da Zazzle
A camiseta satisfez completamente minhas expectativas. Tecido de ótima qualidade, bom caimento, estampa nítida, belas cores. Sem falar na satisfação de poder vestir uma camiseta que realmente tem a cara da gente. Muito bom. Estampa, cores e tudo o mais.
5 de 5 estrelas
Por 13 de julho de 2012 • Compra segura
Camiseta Básica, Branco, Adulto G
Programa de revisão da Zazzle
eu gostei muito do produto! ele ainda não chegou, estou esperando, mas tenho certeza que é o melhor! sou fã do Pastor Metralhadora! ficou muito boa! ficou ótima pra caramba!
Tags
Outras Informações
Identificação do Produto (ID): 235973401797939589
Criado em: 11/10/2010 22:07
Avaliação: G
Itens visualizados recentemente