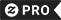Toque/clique na imagem para ver mais RealViewsTM
R$ 47,25
por adesivo
Adesivo Redondo Namorando de carbono 14
Quantidade:
Forma
Adesivos Clássicos Redondos
+R$ 2,00
+R$ 2,00
+R$ 2,00
Tamanho
Tipo de Papel
Sobre Adesivos
Feito por
Sobre Esse Design
Adesivo Redondo Namorando de carbono 14
Carbono-14, 14C, ou radiocarboneto, é um isótopo radioativo de carbono com um núcleo contendo 6 prótons e 8 nêutrons. A sua presença em matérias orgânicas é a base do método de namorando de carbono radioativo até à data, em amostras arqueológicas, geológicas e hidrogeológicas. O carbono-14 foi descoberto em 27 de fevereiro de 1940 por Martin Kamen e Sam Ruben no Laboratório de Radiação da Universidade da Califórnia em Berkeley, embora a sua existência tenha sido sugerida por Franz Kurie em 1934[2]. Existem três isótopos naturais de carbono na Terra: 99% do carbono é carbono-12, 1% é carbono-13 e carbono-14 ocorre em quantidades vestigiais, por exemplo, fazer até 1 parte por trilhão (0,00000000001%) do carbono na atmosfera. A semivida do carbono-14 é de 5.730±40 anos. Decai em azoto-14 através do decaimento beta[3]. A atividade do padrão moderno de radiocarbono[4] é de cerca de 14 desintegrações por minuto (dpm) por grama de carbono[5]. A massa atômica do carbono-14 é de cerca de 14.003241 amu. Os diferentes isótopos de carbono não diferem significativamente nas suas propriedades químicas. Isso é usado na pesquisa química em uma técnica chamada rotulagem de carbono: alguns átomos de carbono-12 de um determinado composto são substituídos por átomos de carbono-14 (ou alguns de carbono-13) para rastreá-los ao longo de reações químicas envolvendo o composto em questão. Teor de [ocultar] 1 Origem e decaimento radioativo 2 Formação de namorando de Radiocarboneto 3 durante os ensaios nucleares 4.1 Em combustíveis fósseis 4.2 No corpo humano 5 Ver também 6 Referências 7 Leitura posterior 8 Ligações externas [edit] Origem e decaimento radioativo O carbono 14 é produzido nas camadas superiores da troposfera e da estratosfera por neutrões térmicos absorvidos pelos átomos de azoto. Quando os raios cósmicos entram na atmosfera, passam por várias transformações, inclusive a produção de nêutrons. Os nêutrons resultantes (1n) participam na seguinte reação: 1n + 14N → 14C + 1H A maior taxa de produção de carbono-14 ocorre em altitudes de 9 a 15 km (30.000 a 50.000 pés) e em latitudes geomagnéticas elevadas, mas o carbono-14 mistura-se facilmente e torna uniforme distribuído pela atmosfera e reage com o oxigênio para formar dióxido de carbono radioativo. O dióxido de carbono também se dissolve na água e permeia os oceanos. O carbono 14 também pode ser produzido no gelo por nêutrons rápidos causando reações de vazamento no oxigênio. O carbono 14 passa então pelo decaimento beta radioativo. Ao emitir um elétron e um elétron antineutrino, o carbono-14 (meia-vida de 5730 anos) decai no isótopo estável (não radioativo) nitrogênio-14. O inventário do carbono-14 na biosfera terrestre é de cerca de 300 milhões de Curies, dos quais a maioria está nos oceanos.[6] [edit] Artigo principal do namorando Radiocarboneto: namorando Radiocarboneto do namorando Radiocarboneto é um método de namorando radiométrico que usa (14C) para determinar a idade dos materiais carbonáticos até cerca de 60 mil anos. A técnica foi desenvolvida por Willard Libby e seus colegas em 1949[7] durante seu mandato como professor na Universidade de Chicago. Libby estimou que a radioatividade do carbono-14 permutável seria de cerca de 14 desintegrações por minuto (dpm) por grama. Em 1960 ganhou o Prêmio Nobel de Química por esse trabalho. Um dos usos frequentes da técnica é até hoje restos orgânicos de sítios arqueológicos. As plantas fixam carbono atmosférico durante a fotossíntese, de modo que o nível de 14C nas plantas e nos animais quando morrem aproximadamente é igual ao nível de 14C na atmosfera na época. No entanto, diminui a partir daí do decaimento radioativo, permitindo estimar a data de morte ou fixação. O nível inicial de 14C para o cálculo pode ser estimado, ou comparado diretamente com dados conhecidos ano a ano, desde dados de anel de árvore (dendrocronologia) até 10.000 anos atrás, ou de depósitos de cavernas (espeleotemas) até cerca de 45.000 anos de idade. Um cálculo ou (mais precisamente) uma comparação direta com os níveis de carbono-14 do anel de árvores ou do depósito de cavernas dá à madeira ou à amostra animal idade de formação. A técnica tem limitações dentro da era industrial moderna, devido ao carbono do combustível fóssil (que tem pouco carbono 14) liberado em grandes quantidades na atmosfera nos últimos séculos. [edit] Formação durante ensaios nucleares Atmosférica 14C, Nova Zelândia[8] e Áustria[9]. A curva neozelandesa é representativa do hemisfério Sul, a curva austríaca é representativa do hemisfério Norte. Os ensaios nucleares de armas atmosféricas quase duplicaram a concentração de 14C no hemisfério Norte [10].Os ensaios nucleares de superfície que ocorreram em vários países entre 1955 e 1980 (ver lista de ensaios nucleares) aumentaram drasticamente a quantidade de carbono-14 na atmosfera e, posteriormente, na biosfera; após os testes, a concentração atmosférica do isótopo começou a diminuir . Um efeito colateral da alteração do carbono atmosférico-14 é que isso permite determinar o ano de nascimento de um indivíduo: a quantidade de carbono-14 no esmalte dentário é medida com espectrometria de massa do acelerador e comparada com registros de concentrações atmosféricas passadas de carbono-14. Como os dentes se formam em uma idade específica e não trocam carbono a partir daí, esse método permite determinar a idade em 1,6 ano. Este método só funciona para os nasceres de indivíduos após 1943[11][12] e deve saber-se se o indivíduo vivia no Norte ou no hemisfério sul na idade em que o dente se teria formado. Um método de namorando depende da lente do olho; proteínas transparentes chamadas "cristalinas" produzidas durante o primeiro ano de vida permanecem inalteradas depois, medindo as concentrações de carbono-14 pode fornecer um registro do tempo de nascimento. As principais restrições à tecnologia são que a pessoa deve ter sido nascer após 1950, a lente deve ser removida enquanto o sujeito está vivo ou no prazo de três dias após a morte, antes de morrer demais, e o indivíduo não pode ter sobrevivido principalmente aos frutos do mar[13] [edit] Ocorrência [edit] Em combustíveis fósseis A maioria dos produtos químicos feitos pelo homem são feitos de combustíveis fósseis, como petróleo ou carvão, em que 14 deveriam ter decaído há muito tempo. No entanto, estes depósitos contêm frequentemente vestígios de carbono-14 (variando significativamente, mas variando entre 1% do rácio encontrado nos organismos vivos e valores comparáveis a uma idade aparente de 40 000 anos para os óleos com os níveis mais elevados de carbono-14)[14]. Isto pode indicar uma possível contaminação por pequenas quantidades de bactérias, fontes subterrâneas de radiação que provocam a reação 14N(n,p) 14C, a degradação direta do urânio (embora as taxas medidas comunicadas de 14C/U em minérios que suportam urânio[15] implicassem aproximadamente 1 átomo de urânio para cada dois átomos de carbono, a fim de causar a relação 14C/12C, medida pela ordem de 10-1 5), ou outras fontes secundárias desconhecidas de produção de carbono-14. A presença de carbono-14 na assinatura isotópica de uma amostra de material carbonáceo indica possivelmente a sua contaminação por fontes biogênicas ou o decaimento de material radioativo nos estratos geológicos circundantes. No âmbito da construção do observatório de neutrinos solares de Borexino, a matéria-prima petrolífera (para síntese do cintilante primário) foi obtida com baixo teor de 14C. Na instalação de ensaio de contagem de borexino, foi determinada uma relação 14C/12C de 1,94x10-18;[16] as reações responsáveis por níveis variados de 14C em diferentes reservatórios de petróleo e os níveis inferiores de 14C no metano foram discutidos por Bonvicini et al[17] [edit] No corpo humano Uma vez que, essencialmente, a comida humana deriva de plantas, o carbono que compõe nossos corpos contém carbono-14 na mesma concentração que a atmosfera. Os decaimentos beta deste radiocarboneto interno contribuem com cerca de 0,01 mSv/ano (1 mrem/ano) para a dose de radiação ionizante de cada pessoa[18]. Esta é pequena quando comparada com as doses de potássio- 40 (0,39 mSv/ano) e radão (variável). O carbono 14 pode ser utilizado como marcador radioativo na medicina. Na variante inicial do teste respiratório de ureia, um teste de diagnóstico para Helicobacter pylori, ureia marcada com aproximadamente 37 kBq (1,0 µCi) de carbono- 14 é fornecido a um doente. Em caso de infecção por H. pylori, a enzima urease bacteriana degrada a ureia em amoníaco e dióxido de carbono marcado radioativamente, que pode ser detectado por uma contagem baixa da respiração do doente[19]. O teste respiratório de ureia-14-C foi substituído em grande parte pelo teste respiratório de ureia-13-C, que não apresenta problemas de radiação.
Tradução Automática
Comentários de clientes
4.8 de 5 estrelas34 Total de Comentários
34 Avaliações
Avaliações de produtos similares
5 de 5 estrelas
Por 25 de março de 2014 • Compra segura
Programa de revisão da Zazzle
Muito boa a qualidade dos adesivos nota 10
Very good quality adhesives note 10. sensacional perfeito
Amazing perfect
5 de 5 estrelas
Por 25 de março de 2014 • Compra segura
Programa de revisão da Zazzle
Muito boa a qualidade dos adesivos nota 10,
Very good quality adhesives note 10,. sensacional perfeito
Amazing perfect better
5 de 5 estrelas
Por 8 de janeiro de 2013 • Compra segura
Programa de revisão da Zazzle
Fiz o pedido e não observei o prazo de entrega corretamente. Daí entrei em contato solicitando alteração, o que foi prontamente atendido, superando minhas expectativas.
Porém o pedido não veio correto, o que solicitei reenvio, e chegou tudo a contento. Tão importante quanto não ter problemas e ter rápida solução para os que eventualmente ocorrerem. Por este motivo, recomendo a Zazzle. Ótima qualidade e acabamento diferenciado.
Tags
Outras Informações
Identificação do Produto (ID): 217801262597972564
Criado em: 17/08/2010 21:02
Avaliação: G
Itens visualizados recentemente